REVIEW KIMIA
DASAR
PERTEMUAN 3

NAMA :
LUFITA
NIM : A1C217027
DOSEN
PENGAMPU : Dr. YUSNELTI, M.Si
PROGRAM STUDI
PENDIDIKAN MATEMATIKA
FAKULTAS
KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS
JAMBI
2017
Bab 1
Pendahuluan
1. Latar belakang
Sejarah perkembangan teori atom dimulai pada sekitar abad kelima
sebelum masehi oleh seorang ahli filsafat Yunani, Democritus (sekitar
tahun 460-370 SM). Democritus mengekspresikan gagasannya bahwa semua materi
tersusun atas partikel-partikel yang sangat kecil dan tidak dapat dibagi-bagi
yang disebut atomos (yang berarti tidak dapat dibagi-bagi). Meskipun gagasan
Democritus saat itu tidak dapdat diterima oleh para ahli filsafat lainnya
seperti Plato dan Aristoteles, konsepnya tetap bertahan selama beberapa abad. Pada
tahun 1808, ilmuwan Inggris, John Dalton merumuskan defenisi yang tepat tentang
partikel-partikel yang tidak dapat dibagi-bagi dan disebut atom. Konsep atom
Dalton lebih terperinci daripada konsep Democritus. Hipotesis pertama
menyatakan bahwa atom dari suatu unsur berbeda dengan atom dari unsur lain.
Dalton tidak menjelaskan struktur dan komposisi dari atom, ia tidak mempunyai
ide seperti apa atom itu sebenarnya tetapi ia menyadari bahwa sifat-sifat yang
berbeda yang ditunjukkan oleh unsur-unsur seperti hidrogen dan oksigen dapat
dijelaskan dengan menganggap bahwa atom-atom hidrogen tidak sama dengan
atom-atom oksigen.
2. Tujuan
·
Untuk mengetahui
pengertian atom, molekul dan mol
·
Untuk mengetahui
hukum kimia
·
Untuk mengetahui
teori atom dalton dan massa atom
·
Untuk mengetahui
konsep mol
·
Untuk mengetahui
cara pengukuran mol atom
·
Untuk mengetahui
cara pengukuran mol dari senyawa : massa molekul dan massa rumus
·
Untuk mengetahui
komposisi persen
·
Untuk mengetahui
rumus kimia
·
Untuk mengetahui
cara mencari rumus molekul dan rumus empiris
Bab 2
Pembahasan
Atom
Atom adalah unit dasar dari semua benda yang terdiri
dari nukleus (inti atom) dan dikelilingi oleh awan elektron bermuatan negatif.
Inti atom terdiri dari proton bermuatan positif dan neutron yang netral
(kecuali pada atom hidrogen yang tidak terdapat neutron). Jari-jari atom
sekitar 3 – 15 nm.Elektron yang terdapat pada atom terikat dengan inti atom
oleh gaya elektromagnetik. Dengan gaya itu pula atom dapat berikatan dengan
atom lainnya dan membentuk sebuah molekul. Hingga kini, atom tidak dapat
dilihat dengan alat optik manapun termasuk mikroskop.
Atom yang mengandung jumlah proton dan elektron yang
sama bersifat netral. Sedangkan jika jumlahnya berbeda disebut ion karena
bermuatan positif atau negatif. Jika jumlah proton lebih banyak, maka atomnya
bermuatan positif. Jika jumlah elektron lebih banyak, maka atomnya bermuatan
negatif. Lebih dari 99,9% massa atom berpusat pada inti atom. Atom terdiri dari
3 partikel dasar yaitu:
1.
Proton: partikel bermuatan positif (+1), diameternya
hanya 1/3 diameter elektron, tetapi memiliki massa sekitar 1840 kali massa
elektron.
2.
Elektron: partikel bermuatan negatif (-1), memiliki
massa paling ringan yaitu hanya 1/1840 kali masa proton atau neutron.
3.
Neutron: partikel tidak bermuatan (netral), memiliki
massa yang kira-kira sama dengan gabungan massa proton dan elektron.
Teori tentang atom terus berkembang
karena manusia penasaran dengan apa yang menyusun semua benda. Manusia berpikir
bahwa ketika kertas dipotong-potong, pasti akan ada saat dimana potongan kertas
sudah sangat kecil sehingga tidak dapat dipotong. Untuk itulah, kata “atom”
berasal dari bahasa Yunani a dan tomos yang
berarti “tidak dapat dipotong” (a=tidak; tomos=terbagi/dipotong).
Jadi, awalnya atom dianggap merupakan unit terkecil yang menyusun semua benda.
Atom memang berukuran sangat kecil. Sebuah tanda titik saja terdapat sekitar 20
juta atom. Kemudian, atom berkembang sesuai dengan perkembangan penelitian dari
berbagai ahli. Berikut adalah perkembangan pengertian atom menurut para ahli
kimia:
1.
Pengertian Atom Menurut Demokritos: Atom
adalah partikel terkecil penyusun seluruh materi di alam semesta.
2.
Pengertian Atom Menurut John Dalton: Atom
adalah partikel terkecil dari suatu unsur yang masih mempunyai sifat seperti
unsurnya.
3.
Pengertian Atom Menurut J.J. Thomson: Atom
adalah bola yang bermuatan positif dan elektron yang bermuatan negatif tersebar
secara merata.
4.
Pengertian Atom Menurut Ernest Rutherford: Atom adalah
partikel yang terdiri dari inti atom, yaitu proton dan neutron yang berada pada
bagian pusat dan dikelilingi elektron-elektron.
Di alam terdapat
banyak jenis atom. Atom-atom tersebut disusun dalam sistem periodik unsur
kimia. Atom-atom disusun berdasarkan jumlah proton di dalam atom. Semua atom
yang ditemukan telah diberi nama dan lambang. Lambang tersebut menganut sistem
Jons Jakob Berzelius. Seorang ahli kimia dari Swedia.
Molekul
Molekul adalah
kumpulan dua atom atau bahkan lebih yang ada didalam suatu susunan tertentu
yang terikat oleh gaya kimia atau ikatan kimia. Molekul terbentuk dari adanya
dua atom atau bahkan lebih yang saling berkaitan antara yang satu dengan yang
lainnya dan juga memiliki unsure- unsure yang sama, missal O2 yang ada pada
sebuah oksigen atau pada atom yang mempunyai unsure yang berbeda yang sering
disebut dengan sebutan molkul senyawa. Contoh H2O yang terdiri dari dua atom H
dan juga satu atom yaitu O.atom- atom itu harus berhubungan dengan kuat, sebab
atom yang tidak kovalen tidak akan bisa dianggap sebagai molekul tunggal.
Molekul juga sering disebut sebagai salah satu dari bagian atom yang paling
kecil dan tidak bisa dipecahkan dari senyawa kimia yang terdiri dari dua atom
atau bahkan lebih yang berkaitan antara yang satu dengan yang lainnya.
Molekul adalah suatu ilmu pengetahuan yang berhubungan dengan atom. Hubungan antara atom dan molekul sangat kuat, bahkan bisa dikatakan jika setiap ada atom pasti disitu ada molekul. Sangat jarang diketahui atau ditemui atom bisa berdiri sendiri, sebab atom saling melekat dan juga saling mengikat satu dengan yang lain. Dari penjelasan tersebut dapat disimpulkan bahwa pengertian molekul adalah sekumpulan atom- atom yang saling terikat satu dengan yang lainnya untuk membentuk bagian yang terkecil dari sebuah senyawa atau zat yang bisa berdiri sindiri. Molekul adalah suatu barang yang sangat kecil sehingga masih terlalu sulit jika harus dilihat dengan menggunakan mata telanjang bulat.
Diatas telah dijelaskan tentang pengertian molekul, saatnya sekarang membahas tentang bentuk dari molekul itu sendiri. Atom yang terdapat dalam molekul yang saling terkait supaya bisa stabil dengan cara berbagi electron sehingga bisa terbentuk suatu molekul. Bentuk dari molekul itu sendiri adalah susunan atom suatu molekul berdasar pada susunan ruangan electron. Walaupun bentuk molekul tidak bisa dilihat dengan jelas, tetapi bentuk dari molekul itu bisa dilihat melalui teori hibridasi dan vsepr.
Dari adanya pengertian molekul ada dua teori yang bisa ditemukan yaitu teori valence shell electron pair of repulsion atau yang sering disebut dengan VSEPR adalah sebuah teori yang bisa menjelaskan adanya struktur ruang pada molekul dengan cara pendekatan secara tepat. Teori VSEPR menjelaskan adanya ikatan antara atom yang bisa mempengaruhi suatu bentuk molekul berdasar tolakan pada sepasang electron disekitar pusat atom. Electron yang dipakai secara berpasangan didalam suatu atom yang ada pada kulit terluar, baik yang terikat ataupun yang bebas. Sedangkan teori hibridasi lemengandalkan pada orbital atom. Hibridasi itu sendiri sendiri adalah suatu proses pencampuran obital sebuah atom didalam suatu atom guna menghasilkan satu orbital atom yang baru sebelum dibentuk sebuah ikatan yang kovalen. Adapun orbital atom itu adalah orbital yang bisa dibentuk sebagai suatu hasil pengabungan dua atau lebih orbital yang tidak setara.
Mol
Mol adalah jumlah
dari suatu zat yang mengandung jumlah satuan dasar (atom, molekul, dan ion)
yang sama dengan atom-atom dalam 12 g isotop karbon (C-12). Mol merupakan
satuan dasar SI untuk sejumlah zat. Pengertian mol dapat kita analogikan
sebagai berikut. Apabila kita menghitung telur dengan satuan lusin (12 telur),
dan kertas dengan satuan rim (500 lembar), maka ahli kimia menghitung jumlah
atom-atom, molekul-molekul, atau ion-ion dengan satuan jumlah yang disebut mol.
Satu lusin merupakan angka yang sama, apakah kita mempunyai 1 lusin jeruk atau 1 lusin semangka. Walaupun 1 lusin jeruk dan 1 lusin semangka tidak mempunyai massa yang sama. Demikian pula, 1 mol magnesium dan 1 mol besi mengandung atom-atom dengan angka yang sama tetapi mempunyai massa berbeda.
Satu lusin merupakan angka yang sama, apakah kita mempunyai 1 lusin jeruk atau 1 lusin semangka. Walaupun 1 lusin jeruk dan 1 lusin semangka tidak mempunyai massa yang sama. Demikian pula, 1 mol magnesium dan 1 mol besi mengandung atom-atom dengan angka yang sama tetapi mempunyai massa berbeda.
Hukum kimia
1. Hukum
Kekekalan Massa (Hukum Lavoisier)
Dalam suatu reaksi kimia, materi bisa berubah menjadi materi yang lain.
Materi yang berubah dalam suatu reaksi disebut pereaksi dan materi yang
terbentuk disebut hasil reaksi.
Seorang ahli
kimia Prancis bernama Anthony Laurent Lavoisier melakukan percobaan. Ia
menimbang massa zat sebelum dan setelah reaksi pemanasan oksida raksa secara
teliti, ternyata terjadi pengurangan massa oksida raksa.
Menurut Lavoisier, ketika oksida raksa dipanaskan menghasilkan gas oksigen,
massa dari oksida raksa berkurang. Lavoisier juga membuktikan kebalikannya,
jika sebuah logam dipanaskan di udara, massanya akan bertambah sesuai dengan
jumlah oksigen yang diambilnya dari udara.
Kesimpulan Lavoisier ini dikenal dengan nama Hukum Kekekalan Massa. Bunyi
hukum kekekalan massa Lavoisier adalah sebagai berikut:
"Pada
setiap reaksi kimia, massa zat-zat yang bereaksi adalah sama dengan massa
produk reaksi."
Hukum ini
dapat juga diungkapkan sebagai berikut:
"Materi
tidak dapat diciptakan atau dimusnahkan,
Dalam
setiap reaksi kimia tidak dapat dideteksi perubahan massa"
2. Hukum
Perbandingan Tetap (Hukum Proust)
Penguraian senyawa air (H2O) pada sumber air seperti air hujan, air sumur,
dan air sungai dapat dilakukan melalui proses elektrolisis. Bagaimanakah
perbandingan dari massa dua unsur yang bersenyawa?
Dari hasil percobaannya, Proust
menyimpulkan dengan apa yang dikenal dengan bunyi
hukum perbandingan tetap (Hukum Proust):
"Pada
setiap reaksi, massa zat yang bereaksi dengan sejumlah tertentu zat lain selalu
tetap, dalam suatu senyawa murni selalu terdiri atas unsur-unsur sama yang
tergabung dalam perbandingan tertentu."
Contoh:
Air
mengandung: hidrogen = 11,19%
Oksigen =
88,81%
Berarti,
jumlah oksigen yang tergabung dengan 1 gram hidrogen dalam air adalah 8 gram.
3. Hukum
Kelipatan Perbandingan (Hukum Dalton)
Dari hasil percobaan, Dalton menyimpulkan sebuah teori yang dikenal dengan
nama Hukum Kelipatan Perbandingan (Hukum Dalton) yang berbunyi:
"Jika
dua unsur dapat membentuk lebih dari satu senyawa maka perbandingan massa dari
suatu unsur yang bersenyawa dengan sejumlah tertentu unsur lain merupakan
bilangan yang sederhana dan bulat."
Perhatikan
tabel perbandingan massa dari unsur-unsur dalam senyawa NO, N2O, dan NO2
berikut.
Dalam senyawa
NO, perbandingan massa nitrogen dan massa oksigen yaitu 7 : 8. Dalam senyawa
N2O, perbandingan massa nitrogen dan massa oksigen yaitu 14 : 8, sedangkan
dalam NO2 yaitu 7 : 16.
Perbandingan
massa oksigen dalam NO dan massa oksigen dalam N2O memiliki nilai yang sama
yaitu 8, sedangkan perbandingan massa nitrogen dalam NO dan nitrogen dalam N2O
berbeda.
Nitrogen
(NI) dalam NO memiliki nilai = 7
Nitrogen
(NII) dalam N2O memiliki nilai = 14
Dapat
disimpulkan bahwa perbandingan massa NI dan NII yaitu 7 : 14 = 1 : 2.
Bagaimanakah dengan perbandingan massa oksigen dalam NO dengan massa oksigen
dalam NO2?
4. Hukum
Perbandingan Volume (Hukum Gay Lussac)
Telah banyak ilmuwan sebelum Gay Lussac yang menemukan bahwa gas hidrogen
bereaksi dengan gas oksigen membentuk air.
Di antaranya
Henry Cavendish, William Nicholson, dan Anthony Carlise yang menemukan
perbandingan volume hidrogen dan oksigen, tetapi belum menemukan perbandingan
volume air yang dihasilkan dari reaksi antara gas hidrogen dan oksigen.
Joseph Louis-Gay Lussac, seorang ahli kimia Prancis pada 1808 mengamati
volume gas-gas yang terlibat dalam suatu reaksi. Pengamatan menunjukkan bahwa
pada reaksi pengukuran temperatur dan tekanan yang sama diperoleh hasil sebagai
berikut.
a. Satu bagian
volume gas hidrogen bereaksi dengan satu bagian volume gas klorin menghasilkan
dua volume gas hidrogen klorida H2(g) + Cl2(g)→2 HCl(g)
b.
Dua bagian volume gas hidrogen bereaksi dengan satu
bagian volume gas oksigen menghasilkan 2 bagian volume air 2 H2(g) +
O2(g)→ 2 H2O(g)
Dari data
tersebut, Gay Lussac menyimpulkan bunyi Hukum Perbandingan Volume:
"Pada
kondisi temperatur dan tekanan yang sama, perbandingan volume gas-gas pereaksi
dengan gas-gas hasil reaksi merupakan bilangan yang bulat dan mudah."
Dapat juga
dikatakan:
"Pada
kondisi temperatur dan tekanan yang sama, perbandingan volume gas-gas sama
dengan perbandingan koefisien dalam reaksi yang sama."
Teori Atom Dalton dan Massa Atom
Para ahli kimia dari akhir abad ke-18 masih
meraba-raba bagaimana bentuknya zat agar memefitihi hukum-hukum di atas dan
pada tahun 1803 seoraing guru dan ilmuwan Inggris yang bernama John Dalton
mengemukakan teorinya yang disebut teori atom Dalton yang telah mengubah arah
Ilmu kimia. Konsep dari suatu atom bukanlah hal yang benar.
Ahli-ahli filsafat Yunani pada tahun 500 SM telah mengemukakan kemungkinan
bahwa zat terdiri dari partikel-partikel kecil yang tak kelihatan. Tetapi prang
Yunani kuno tak mempunyai data untuk menjelaskannya, sehingga usulan mereka
hanyalah berupa sedikit latihan pemikiran. Tetapi teori Dalton sedikit berbeda,
sebab teorinya telah menjelaskan pengamatan hukum kekekalan massa dan
perbandingan.
Teori
atom Dalton dapat dikemukakan dalam postulat berikut ini:
a.
Zat
terdiri dari partikel-partikel kecil yang tak- kelihatan yang disebut atom.
b.
Semua
atom dari suatu elemen adalah sama, tetapi berbeda dari atom elemen lainnya
(Berarti semua atom dari suatu elemen mempunyai massa yang sama, tetapi berbeda
dari massa atom elemen lainnya).
c.
Senyawa
kimia dibentuk oleh atom-atom elemennya dalam suatu perbandingan yang tetap.
Suatu reaksi kimia
hanyalah berupa penggeseran atom dari suatu senyawa ke yang lain. Sedangkan atom masing-masing masih tetap berfungsi
dan tak berubah .Tes dari teori ini adalah kemampuannya untuk menerangkan
fakta.Pertama, kita lihat hukum
kekekalan massa. Bila suatu reaksi kimia hanya mengambil atom-atom dari reaktan
Ialu membagikannya pada hasil reaksi, maka jumlah atom dari masing-masing
elemen harus tetap sama (tentunya kita anggap tak ado atom yang dapat keluar
masuk tabung reaksi). Karena
atom selama reaksi tak mengalami perubahan massa,berarti jurnlah massa atom
harus tetap sama. Dengan perkataan lain, selama reaksi massanya harus tetap
konstan dan memang ini yang dikatakan oleh Ilukum Kekekalan Massa.
Hokum Perbandingan Tetap pun
mudah diterangkan. Untuk melihat HE, kita bayangkan dua elemen A dan B yang
membentuk suatu senyawa dimana tiap molekul dari zat tersebut terdiri dari
sebuah atom A dan sebuah atom B (Ingat bahwa sebuah molekul dapat dianggap
sebagai suatu kumpulan atom yang terikat satu sama lain cukup kuat
sehingga berperan dan
dikenal sebagai sebuah partikel). Misalkan atom A dua kali lebih berat dari
atom B, sehingga bila atom B mempunyai massa
1 unit, maka massa atom A adalah 2 unit. Berikut ini terlihat bagaimana
massa dari A dan B berubah sesuai dengan jumlah molekul.
Jumlah
Molekul
|
Jumlah
Atom A
|
Massa A
|
Jumlah
Atom B
|
Massa B
|
Perbandingan
Massa A/B
|
1
|
1
|
2 unit
|
1
|
1
|
2/1
|
2
|
2
|
4 unit
|
2
|
2
|
4/2 = 2/1
|
10
|
10
|
20 unit
|
10
|
10
|
20/10 = 2/1
|
500
|
500
|
1000 unit
|
500
|
500
|
1000/500 = 2/1
|
Perhatikan bahwa berapapun
molekul yang ada masing-masing dengan perbandingan atomnya yang sama yaitu 1,
maka perbandingan massanya juga sama.
Massa atom
Kunci
suksenya teori atom Dalton adalah pernyataan bahwa tiap elemen mempunyai
atom dengan massa atom yang khusus. Hal ini telah dijelaskan Hukum-hukum kimia,
sehingga ahli-ahli kimia segera mencari bagaimana cara untuk mengukur
massa atom. Tetapi bagaimana hal ini dapat dikerjakan? Atom terlalu kecil
untuk dilihat dan diukur secara sendiri-sendiri dalam timbangan di
laboratoritun.
Pada
pembicaraan di atas kita merneriksa suatu tu hipotesa dimana senyawa
dibentuk dari dua atom, sebuah atom A dan sebuah atom B. Kita lihat bahwa
perbandingan massa dari tiap sampel adalah 2:1, karena perbandingan dari
massa atom-atormnya harus selalu 2 : 1. Sebab itu dengan menentukan
perbandingan massa dari elemen-elemennya dalam sampel yang besar, kita
dapat menentukan perbandingan massa atom dari senyawa tersebut. Sekarang kita
lihat pada elemen-elemen dan senyawa yang sebenarnya.
Hidrogen
dan Fluor membentuk senyawa yang disebui hidrogen fluorida Rumusnya adalah
HF, sehingga sebuah molekul HF mengandung sebuah atom Hidrogen dan
sebuah atom Fluor. Dalam sampel senyawa ini, selalu ditemukan bahwa massa fluor
adalah 19 x massa hidrogen. Karena atom-atomnya berada dalam jumlah yang sama
dapat disimpulkan bahwa tiap atom fluor harus 19 x lebih berat dari atom
hidrogen. Karena itu kita telah menemukan massa relatif dari
atom-atom hidrogen dan fluor.
Dalam
dua contoh yang kita periksa ini, kita lihat bahwa dengan mengukur perbandingan
massa dari elemen-elemennya dapat ditentukan massa dari atom-atomnya.
Syaratnya adalah kita harus mengetahui rumus dari senyawanya. Hambatan
yang besar dalam penentuan massa dari atom-atom ialah perlunya
diketahui rumus dari senyawanya, tapi kemudian ditemukan cara untuk
mendapatkan rumus tersebut, sehingga beberapa massa relatif dari atom-atoni
elemen ditemukan. Tetapi ini hanyalah massa relatif yang menyatakan berapa kali
suatu atom lebih berat dari atom lainnya. Kami ingin memberi harga dalam angka
pada massa atom-atom ini dan ini baru dapat dilak-itkan bila massa dari salah
satu atom elemennya diketahui, sehingga massa dari elemen-elemen lain dapat
dihitung berdasarkan angka perbandingannya.
Karena atom terlalu kecil untuk
dilihat dan ditimbang dalam satuan gram pada suatu timbangan, suatu skala massa
atom dibuat dimana massa diukur dalam satuan massa atom (Simbol SI adalah u). Pemilihan untuk skala
standar ini sangat sukar, karena konsep Dalton tak seluruhnya benar, hampir
semua elemen dalam alam berada dalam campuran atom (disebut isotop) dengan
massa sedikit berbeda, untungnya hal ini tak mempengaruhi hasil akhir dari
teori Dalton, karena elemen dalam tiap sampel cukup besar untuk dapat dilihat
sehingga massa rata-rata dari demikian banyak atom same, sehingga elemen akan berperan
sebagai atom tunggalnya yang mempunyai massa rata-rata. Tetapi karena secara
relatif jumlah yang besar dari berbagai isotop dari satu elemen masih dapat
berubah dalam waktu yang lama, diputuskan untuk memilih sebuah isotop dari
sebuah elemen untuk menentukan besarnya satuan massa atom Isotop tersebut
adalah salah satu dari karbon dan dinamakan. Karbon-12. la diberi tanda massa tepat 12 u, sehingga satuan
massa atom didefenisikan sebagai 1/12 dari massa atom isotop ini. Dengan
memilih bahwa satuan massa atom ulcurannya sebesar di etas, massa atom dari
berbagai elemen harganya akan mendekati bilangan bulat.
Suatu
daftar yang lengkap dari massa atom berada pada sampel dalam dari buku ini dan
diberikan juga simbul dari elemen-elemen pada susunan berkala. Angka dalam
daftar ini adalah harga rata-rata dari massa atom relatif, berarti is adalah
massa rata-rata yang dinyatakan dalam satuan massa atom dari campuran
isotop-isotop yang ditemukan.
Hukum Perbandingan Berganda
Hal lain vang menarik dari teori
atom Dalton adalah ditemukannya Hukum Campuran Kimia lain yang dinamakan Hukum Perbandingan Berganda yang
dapat dinyatakan sebagai berikut: Misalkan kita mempunvai dua sampel
senyawa yang dibentuk oleh dua elemen yang sama. Bila massa dari salah
satu elemen dalam kedua sampel itu sama, maka massa dari elemen yang lain
berada dalam perbandingan angka yang kecil dan bulat. Hukum ini yang
terutama penting untuk sejarah, lebih mudah dimengerti bila diberi contoh.
Seperti diketahui karbon dapat membentuk dua macam senyawa dengan oksigen yaitu
karbon monoksida dan karbondioksida. Dalam 2,33 g karboamonoksida, ditemukan
1,33 g oksigen yang bergabung dengan 1,00 g karbon. Sedangkan dalam 3,66 g
karbondioksida, ditemukan 2,66 g oksigen yang bergabung dengan 1,00 g karbon.
Perhatikan bahwa massa karbon yang sama (1,00 gram) berada dalam perbandingan 2
: 1 (perbandingan dengan angka yang kecil dan bulat.
2,66 gram : 1,33 gram = 2 :
1 1
Hal ini sejalan dengan
teori atom yaitu bila sebuah molekul karbon monoksida (CO) mengandung satu atom
C dan satu atom 0 dan sebuah molekul karbondioksida (CO2)
mengandung 1 atom C dan 2 atom 0, berarti kita mempunyai molekul karbon
yang jumlahnya sama, kita mempunyai jumlah karbon atom dan massa yang
sama.
Konsep Mol
Mol adalah satuan
bilangan kimia yang jumlah atom-atomnya atau molekul-molekulnya sebesar
bilangan Avogadro dan massanya = Mr senyawa itu.
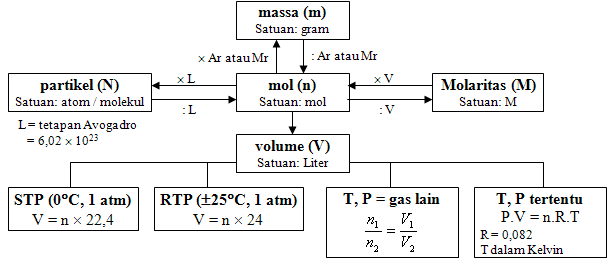
Jika bilangan Avogadro = L maka :
L = 6.023 x 1023
1 mol atom = L buah atom, massanya = Ar atom tersebut.
1 mol molekul = L buah molekul massanya = Mr molekul
tersebut.
Massa 1 mol zat disebut sebagai massa molar zat
Massa 1 mol zat disebut sebagai massa molar zat
1. Hubungan jumlah mol dengan jumlah partikel
Satu mol menyatakan jumlah zat partikel yang
terkandung didalamnya yang dinyatakan dalam satuan bilangan avogadro = 6,02 x
1023
1 mol = 6,02 x 1023 parikel (L)
Hubungan antara jumlah mol dan jumlah partikel dapat
di rumuskan sebagai berikut :
Jumlah mol X = jumlah partikel X / L
Jumlah partikel X = n x L partikel (atom, molekul atau
ion)
2. Hubungan jumlah mol dengan massa molar
Untuk menghitung jumlah mol zat yang diketahui
massanya atau sebaliknya dapat digunakan rumus sebagai berikut :
Jumlah mol = massa zat / massa molar
Karena massa molar nilainya sama dengan Ar atau Mr
suatu zat rumusnya dapat ditulis sebagai berikut :
n = g/Ar atau n = g/Mr
dengan n = jumlah mol
m =
massa zat (g)
Ar
atau Mr = massa atom atau massa molekul relatif
3. Hubungan jumlah mol dengan volume
Berbeda dengan zat padat dan zat cair yang memiliki
volume tetap, zat berwujud gas volumenya berubah-ubah tergantung pada suhu,
tekanan, dan jumlah zatnya. Hubungan antara volume, suhu dan tekanan dapat
dinyatakan dengan menggunakan rumus gas sebagai berikut :
P x V = n x R x T
Dengan p = tekanan (atm)
V =
volume (l)
n
= jumlah mol gas (mol)
R =
tetapan gas = 0,082 L atm mol K
T =
suhu (K)
a.
Volume milar pada keadaan standar
Adalah volume
1 mol zat dalam wujud gas jika diukur dalam keadaan standar yaitu suhu 0̊̊̊̊̊ C
(273 K) dan tekanan 1 atm (76 mmHg). Volume molar gas pada keadaan standar adalah 22,4 L. Jadi hubungan antar jumlah mol
gas dan volume dapat dinyatakan sebagai berikut :
Jumlah mol gas
X = volume gas X / 22,4
Volume gas X =
jumlah mol gas X x 22,4 L
b.
Volume molar pada keadaan ruang
Adalah yang
diukur pada keadaan ruang yaitu suhu 25 ̊ C (298 K) dan tekanan 1 atm (76
mmHg).
Volume gas X =
jumlah mol X x VSTP
c.
Volume pada saat P dan T tertentu
Untuk mengukur
volume gas yang dikur pada keadaan selaim keadaan standar, rumus yang digunakan
adalah rumus gas ideal berikut :
P x V = n x R
x T atau V = n x R x T / P
d.
Volume pada saat keadaan perbandingan
Sedangkan
untuk menghitung volume gas yang diukur pada keadaan gas lain, digunakan rumus
gas berikut :
V1 / V2
= n1 / n2
Pengukuran Mol dari Senyawa : Massa
Molekul dan Massa Rumus
Satuan mol sekarang
dinyatakan sebagai jumlah par-tikel (atom, molekul, atau ion) dalam suatu zat.
Para ahli sepakat bahwa satu mol zat mengandung jumlah partikel yang sama
dengan jumlah partikel dalam 12,0 gram isotop C-12 yakni 6,02 x 1023 partikel. Jumlah partikel ini disebut
Bilangan Avogadro (NA = Number Avogadro) atau dalam bahasa Jerman Bilangan
Loschmidt (L).
Jadi, definisi satu mol adalah sebagai berikut.
Satu mol zat
menyatakan banyaknya zat yang mengan-dung jumlah partikel yang sama
dengan jumlah partikeldalam 12,0 gram isotop C-12.
Misalnya:
1. 1 mol unsur Na
mengandung 6,02 x 1023 atom Na.
2. 1 mol senyawa air
mengandung 6,02 x 1023 molekul air.
3. 1 mol senyawa ion
NaCl mengandung 6,02 x 1023 ion Na+ dan 6,02 x 1023ion Cl–.
Hubungan
Mol dengan Jumlah Partikel
Hubungan mol dengan jumlah partikel dapat dirumuskan:
kuantitas (dalam mol) = jumlah partikel / NA
atau
jumlah partikel = mol x NA
Contoh soal:
Suatu sampel mengandung 1,505 x 1023 molekul Cl2, berapa mol
kandungan Cl2 tersebut?
Jawab:
Kuantitas (dalam mol)
Cl2 = jumlah partikel Cl2 / NA
= 1,505 x 1023 / 6,02 x 1023
= 0,25 mol
Hubungan Mol dengan Massa
Sebelum membahas hubungan mol dengan massa, kalian
harus ingat terlebih dahulu tentang Massa Atom Relatif (Ar) dan Massa
Molekul Relatif (Mr). Masih ingat kan? Kalau begitu kita cek ingatan kalian
dengan mengerjakan soal dibawah ini.
1.
Hitung Mr H2SO4 (Ar H = 1, S = 32, dan O = 16)!
2.
Diketahui massa atom relatif (Ar) beberapa unsur
sebagai berikut.
Ca = 40, O = 16, H = 1
Tentukan massa molekul relatif (Mr) senyawa Ca(OH)2!
Sudah ingat kan? Maka kita langsung ke materi
selanjutnya yaitu mengenai massa molar.
Massa molar menyatakan massa yang dimiliki oleh 1 mol
zat, yang besarnya sama dengan Ar atau Mr.
Untuk unsur:
1 mol unsur = Ar gram, maka dapat dirumuskan:
Massa 1 mol zat = Ar zat dinyatakan dalam gram
atau
Massa molar zat tersebut = besar Ar zat gram/mol
Untuk senyawa:
1 mol senyawa = Mr gram, maka dapat dirumuskan:
Massa 1mol zat = Mr zat dinyatakan dalam gram
atau
Massa molar zat tersebut = besar Mr zat gram/mol
Jadi perbedaan antara massa molar dan massa molekul
relatif adalah pada satuannya. Massa molar memiliki satuan gram/mol sedangkan
massa molekul relatif tidak memiliki satuan.
Hubungan antara mol dengan massa adalah:
Kuantitas (dalam mol) = Massa senyawa atau unsur
(gram) / Massa molar senyawa atau unsur (gram/mol)
Hubungan Mol dengan
Volume
a. Gas
pada keadaan standar
Pengukuran kuantitas
gas tergantung suhu dan tekanan gas. Jika gas diukur pada keadaan standar, maka
volumenya disebut volume molar. Volume molar adalah volume 1 mol gas yang
diukur pada keadaan standar. Keadaan standar yaitu keadaan pada suhu 0 °C (atau
273 dan tekanan 1 atmosfer (atau 76 cmHg
atau 760 mmHg) atau disingkat STP (Standard Temperature and Pressure).
Besarnya volume molar gas dapat ditentukan dengan
persamaan gas ideal: PV= nRT
P = tekanan = 1 atm
n = mol = 1 mol gas
T = suhu dalam Kelvin = 273 K
R= tetapan gas = 0,082 liter atm/mol K
Maka:
P V = nRT
V =1 x 0,082 x 273
V = 22,389
V = 22,4 liter
Jadi, volume standar =
VSTP = 22,4 Liter/mol.
Dapat
dirumuskan: V = n x Vm
n = jumlah mol
Vm = VSTP = volume
molar
Contoh soal:
1) Berapa kuantitas (dalam mol) gas hidrogen yang
volumenya 6,72 liter, jika diukur pada suhu 0 °C dan tekanan 1 atm?
Jawab:
Kuantitas (dalam mol)
H2 = volume H2/ VSTP
= 6,72 L / 22,4
mol/L
= 0,3 mol
2) Hitung massa dari
4,48 liter gas C2H2 yang diukur
pada keadaan standar!
Jawab:
Kuantitas (dalam mol)
C2H2 = volume C2H2 / VSTP
= 4,48 / 22, 4
= 0,2 mol
Massa C2H2 = mol x
Massa molar C2H2
= 0,2 mol x 26 gram/mol
= 5,2 gram
3) Hitung volume dari
3,01 x 1023 molekul NO2 yang diukur
pada suhu 0 °C dan tekanan 76 cmHg!
Jawab:
kuantitas (dalam mol)
NO2 = jumlah partikel /NA
= 3,01 x 1023 partikel / 6,02 x 1023 partikel/mol
= 0,5 mol
Volume NO2 = mol x VSTP
= 0,5 mol x 22,4 L/mol
= 11,2 liter
b. Gas
pada keadaan nonstandar
Jika volume gas diukur pada keadaan ATP (Am-bient
Temperature and Pressure) atau lebih dikenal keadaan non–STP maka menggunakan
rumus:
P V = n R T
P = tekanan, satuan P adalah atmosfer (atm)
V = volume, satuan Vadalah liter
n = mol, satuan nadalah mol
R = tetapan gas = 0,082 liter atm / mol K
T = suhu, satuan T adalah Kelvin (K)
Contoh soal:
Tentukan volume 1,7 gram gas amonia yang diukur pada
suhu 27 °C dan tekanan 76 cmHg!
Jawab:
n = massa amonia / massa molar
amonia
= 1,7 gram / 17 gram/mol
= 0,1 mol
P
= (76 cmHg / 76 cmHg) x 1 atm = 1
atm
T
= (t + 273) K = 27 + 273 = 300 K
P
V = n R T
1 atm × V = 0,1 mol × 0,082 L atm / mol K × 300 K
V
= 2,46 L
Komposisi Persen
Komposisi persentase merupakan
persentase berdasarkan bobot (massa) setiap unsur dalam senyawa tersebut.
Penentuan komposisi persentase unsur merupakan salah satu dari
analisis pertama yang dilakukan oleh para kimiawan saat mempelajari senyawa
baru. Sebagai contoh, suatu senyawa mempunyai persentase massa unsur sebagai
berikut : 26,4% Na, 36,8% S, dan 36,8% O. Kita dapat mengasumsikan massa
senyawa sebesar 100 gram (basis persentase adalah per 100), sehingga persentase
tersebut dapat digunakan sebagai massa unsur. Dengan demikian, mol
masing-masing unsur dapat ditentukan.
mol Na = 26,4 gram / 22,99 gram.mol-1 =
1,15 mol Na
mol S = 36,8 gram / 32,07 gram.mol-1 =
1,15 mol S
mol O = 36,8 gram / 16,00 gram.mol-1 =
2,30 mol.
Rumus kimia
Rumus kimia zat menyatakan jenis dan jumlah relatif atom-atom yang
terdapat dalam zat itu. Angka yang menyatakan jumlah atom suatu unsur dalam
rumus kimia disebut angka indeks.
Rumus kimia juga
disebut rumus molekul
adalah cara ringkas memberikan informasi mengenai perbandingan atom-atomyang menyusun suatu senyawa kimia tertentu,
menggunakan sebaris simbol zat kimia, nomor, dan kadang-kadang simbol yang lain
juga, seperti tanda
kurung, kurung
siku,
dan tanda plus (+) dan minus (-). Jenis paling sederhana dari rumus kimia
adalah rumus
empiris,
yang hanya menggunakan huruf dan angka.
Untuk senyawa molekular, rumus ini
mengidentifikasikan setiap unsur kimia penyusun
dengan simbol kimianya dan menunjukkan jumlah atom dari setiap unsur
yang ditemukan pada masing-masing molekul diskrit dari senyawa tersebut.
Jika suatu molekul mengandung lebih dari satu atom unsur tertentu, kuantitas
ini ditandai dengan subskrip setelah simbol kimia
(walaupun buku-buku abad ke-19 kadang
menggunakan superskrip). Untuk senyawa ionik dan zat
non-molekular lain, subskrip tersebut menandai rasio unsur-unsur dalam rumus empiris.
Misalnya: C6H12O6:
glukosa
Seorang kimiawan berkebangsaan Swedia abad ke-19
bernama Jöns Jacob Berzelius adalah
orang yang menemukan sistem penulisan rumus kimia.
Rumus Empiris dan Rumus Molekul
Rumus molekul adalah
rumus yang menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu
molekul senyawa. Jadi rumus molekul menyatakan susunan sebenarnya dari molekul
zat.
Contoh rumus molekul :
a. Rumus molekul air
yaitu H2O yang berarti dalam satu molekul air terdapat dua
atom hidrogen dan satu atom oksigen.
b. Rumus molekul
glukosa C6H12O6 yang berarti dalam
satu molekul glukosa terdapat 6 atom karbon, 12 atom hidrogen, dan 6 atom
oksigen.
Rumus empiris adalah
rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang
menyusun suatu senyawa. Rumus kimia senyawa ion merupakan rumus empiris.
Contoh rumus empiris:
a. Natrium klorida
merupakan senyawa ion yang terdiri atas ion Na+ dan ion Cl– dengan
perbandingan 1 : 1. Rumus kimia natrium klorida NaCl.
b. Kalsium klorida
merupakan senyawa ion yang terdiri atas ion Ca2+ dan ion Cl– dengan
perbandingan 2 : 1. Rumus kimia kalsium klorida CaCl2.
Pada kondisi kamar,
sebagian unsur-unsur ada yang membentuk molekul-molekul. Rumus kimia
unsur-unsur semacam ini tidak digambarkan hanya dengan lambang unsurnya,
melainkan unsur beserta jumlah atom yang membentuk molekul unsur tersebut.
Contoh:
a. Rumus kimia gas
oksigen yaitu O2, berarti rumus kimia gas oksigen terdiri atas
molekul-molekul oksigen yang dibangun oleh dua atom oksigen.
b. Rumus kimia fosfor
yaitu P4, berarti rumus kimia unsur fosfor terdiri atas
molekul-molekul fosfor yang tiap molekulnya dibentuk dari empat buah atom
fosfor.
Semua senyawa
mempunyai rumus empiris. Senyawa molekul mempunyai rumus molekul selain rumus
empiris. Pada banyak senyawa, rumus molekul sama dengan rumus empirisnya.
Senyawa ion hanya mempunyai rumus empiris. Jadi, semua senyawa yang mempunyai
rumus molekul, pasti memiliki rumus empiris. Namun, senyawa yang memiliki rumus
empiris, belum tentu mempunyai rumus molekul.
Contoh :
Senyawa
|
Rumus Molekul
|
Rumus Empiris
|
Air
|
H2O
|
H2O
|
Glukosa
|
C6H12O6
|
CH2O
|
Langkah – langkah menentukan rumus empiris dan rumus
molekul adalah sebagai berikut :

Tidak ada komentar:
Posting Komentar