REVIEW
KIMIA DASAR
PERTEMUAN
KE-10

NAMA
: LUFITA
NIM
: A1C217021
DOSEN
PENGAMPU : Dr. YUSNELTI, M.Si
PRODI PENDIDIKAN MATEMATIKA
JURUSAN
MATEMATIKA DAN IPA
FAKULTAS
KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS
JAMBI
2017
BAB
1
PENDAHULUAN
1.1
Latar Belakang
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang
mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif,
dan neutron yang bermuatan netral (kecuali
pada inti atom Hidrogen-1, yang tidak memiliki neutron). Elektron-elektron pada sebuah atom
terikat pada inti atom oleh gaya
elektromagnetik.
Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan membentuk
sebuah molekul. Atom yang mengandung jumlah proton
dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton
dan elektron yang berbeda bersifat positif atau negatif dan disebut
sebagai ion. Atom dikelompokkan berdasarkan jumlah proton dan
neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom
menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang
berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi.
Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan
oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18,
para kimiawan meletakkan dasar-dasar pemikiran
ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih
jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal
abad ke-20, para fisikawan berhasil menemukan struktur dan
komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak
dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan
kemudian berhasil memodelkan atom.
Dalam pengamatan sehari-hari, secara
relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang
secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan
peralatan khusus seperti mikroskop
gaya atom. Lebih dari
99,9% massa atom berpusat pada inti atom, dengan proton dan neutron yang
bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan
inti yang tidak stabil, yang dapat mengalami peluruhan
radioaktif. Hal ini
dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan
neutron pada inti. Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami
transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada
atom menentukan sifat-sifat kimiawi sebuah unsur, dan memengaruhi
sifat-sifat magnetis atom tersebut.
1.2 Tujuan
·
Mengetahui
struktur elektronik dan susunan berkala
·
Mengetahui
radiasi elektromagnetik dan spektrum atom
·
Mengetahui
struktur atom dan teori Bohr
·
Mengetahui
sifat gelombang benda : mekanisme gelombang
·
Mengetahui
perputaran elektron (spin) dan prinsip pembatasan (pauli)
·
Mengetahui
susunan berkala dan konfigurasi elektron
·
Mengetahui
bentuk orbital atom
·
Mengetahui
perbedaan sifat dikaitkan dengan struktur atom
BAB 2
PEMBAHASAN
2.1 STRUKTUR
ELEKTRONIK DAN SUSUNAN BERKALA
Kenyataan
yang ditemukan dalam kimia, seperti yang telah dipelajari sebelumnya merupakan
bagian yang sangat vital dalam ilmu kimia. Kita belum dapat menyatakan bahwa
kita tahu ilmu kimia, jika kita belum mengetahui bagaimana sifat beberapa zat.
Kenyataan ini hanya merupakan bagian dari ilmu kimia. Kita tidak boleh puas
hanya dengan mengetahui bagaimna zat menunjukkan sifatnya, kita juga perlu
mengetahui apa sebabnya. Apa sebanya ada unsur logam dan ada pula unsur
nonlogam. Mengapa senyawa nonlogam berbentuk molekuler dimana senyawa
logam-nonlogam cenderung berbentuk ion. Dalam susunan berkala mengapa banyak
tempat-tempat yang kosong? Contoh-contoh ini merupakan sebagai pertanyaan yang
muncul setelah kita pelajari kenyataan yang ada.
Kita
telah mempelajari bahwa suatu atom terdiri dari proton dan neutron, dimana
intinya terletak di tengah-tengah atom dan di kelilingi sejumlah elektron agar
atom itu netral. Gambaran struktur atom sudah cukup untuk menerangkan beberapa
sifat unsur misalnya adanya isotop tetapi belum dapat menerangkan sifat kimia
dan fisika atom tersebut.
Jika
atom bereaksi, hanya bagian luarnya yang yang berhubungan. Intinya sangat kecil
dan terletak jauh sekali dalam atom, sehingga inti-inti ini tidak pernah
berhubungan. Oleh sebab itu persamaan dan perbedaan diantara atom-atom dari
bermacam-macam unsur harus diteliti dengan cara bagaimana elektron ini disusun
dibagian luar atom. Penyusunan elektron ini disebut struktur elektronik atom.
Elektron
dalam atom bertempat mengelilingi inti atom. Elektron disusun berdasarkan
(level) tingkat energi yang semakin meningkat yang disebut dengan kulit.
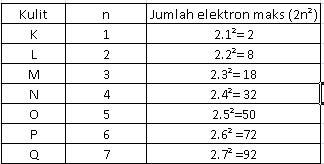
·
Kulit
1 = energi terendah (mengemban maksimum 2 elektron)
·
Kulit
2 (mengemban 2 dan 8 elektron)
·
Kulit
3 (mengemban maksimum 18 elektron walaupun biasanya hanya 8 elektron).
·
Dst
2.2 RADIASI
ELEKTROMAGNETIK DAN SPEKTRUM ATOM
·
Radiasi
elektromagnetik
Radiasi elektromagnetik adalah kombinasi medan listrik dan medan magnet yang berosilasi dan merambat lewat ruang dan
membawa energi dari satu tempat ke tempat yang
lain. Gelombang elektromagnetik merupakan gelombang yang tidak
memerlukan medium dalam perambatannya. Cahaya tampak adalah salah satu bentuk radiasi
elektromagnetik. Setiap muatan listrik yang memiliki percepatan memancarkan
radiasi elektromagnetik. Ketika kawat (atau panghantar seperti antena) menghantarkan arus bolak-balik, radiasi elektromagnetik dirambatkan
pada frekuensi yang sama dengan arus listrik. Bergantung pada situasi,
gelombang elektromagnetik dapat bersifat seperti gelombang atau seperti partikel. Sebagai gelombang, dicirikan oleh
kecepatan (kecepatan
cahaya), panjang gelombang, dan frekuensi. Kalau dipertimbangkan sebagai
partikel, mereka diketahui sebagai foton, dan masing-masing mempunyai energi berhubungan dengan frekuensi
gelombang ditunjukan oleh hubungan Planck E = Hf, di mana E adalah
energi foton, h ialah konstanta Planck — 6.626 × 10 −34 J·s
— dan f adalah
frekuensi gelombang.
Einstein kemudian memperbarui rumus ini
menjadi Ephoton =
hf.
·
Spektrum
atom
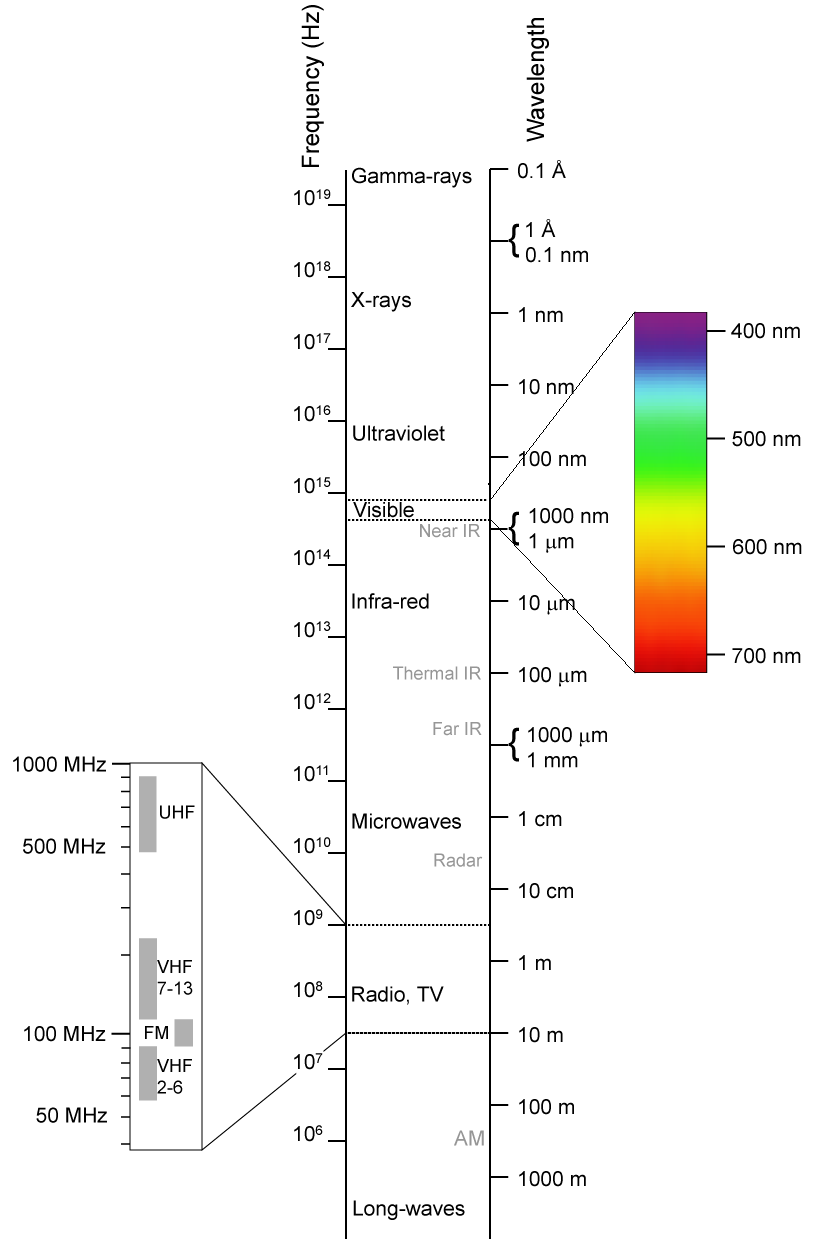
Spektrum
atom adalah radiasi yang dihasilkan
oleh atom yang tereksitasi. Spektrum atom dibagi menjadi dua, yaitu:
1. Spektrum kontinu : radiasi yang dihasilkan oleh atom yang tereksitasi yang terdiri dari berbagai warna yang bersinambungan, yaitu ungu, biru, hijau, kuning, jingga, merah.
1. Spektrum kontinu : radiasi yang dihasilkan oleh atom yang tereksitasi yang terdiri dari berbagai warna yang bersinambungan, yaitu ungu, biru, hijau, kuning, jingga, merah.

Semakin besar panjang gelombang maka semakin kecil energinya, maka artinya
sinar ungu mempunyai foton dengan energi terbesar, sedangkan sinar merah
mempunyai foton dengan energi terkecil.
2. Spektrum diskontinu atau spektrum garis : radiasi yang dihasilkan oleh atom yang tereksitasi yang hanya terdiri dari beberapa warna garis yang terputus putus.
2. Spektrum diskontinu atau spektrum garis : radiasi yang dihasilkan oleh atom yang tereksitasi yang hanya terdiri dari beberapa warna garis yang terputus putus.

Gambar diatas adalah contoh dari radiasi gas hydrogen yang hanya memiliki beberapa garis warna yang terputus putus, yaitu ungu, biru, merah.
2.3 STRUKTUR ATOM DAN TEORI BOHR
Istilah
atom berasal dari Bahasa Yunani, yang berarti tidak dapat dipotong ataupun
sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang
tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para
kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat
tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode
kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil
menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan
bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan
kemudian berhasil memodelkan atom.
Struktur atom merupakan satuan
dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan
negatif yang mengelilinginya. Inti atom mengandung campuran proton yang
bermuatan positif dan neutron yang bermuatan netral (terkecuali pada Hidrogen-1
yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada
inti atom oleh gaya elektromagnetik. Demikian pula sekumpulan atom dapat
berikatan satu sama lainnya membentuk sebuah molekul. Atom yang mengandung
jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung
jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan
merupakan ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron pada inti atom tersebut. Jumlah proton pada
atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop
unsur tersebut.
Relatif terhadap pengamatan
sehari-hari, atom merupakan objek yang sangat kecil dengan massa yang sama
kecilnya pula. Atom hanya dapat dipantau menggunakan peralatan khusus seperti
mikroskop penerowongan payaran. Lebih dari 99,9% massa atom berpusat pada inti
atom, dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling
tidak memiliki satu isotop dengan inti yang tidak stabil yang dapat
mengalami peluruhan
radioaktif. Hal ini
dapat mengakibatkan transmutasi yang mengubah jumlah proton dan neutron pada
inti. Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun
orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut
dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi
antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur dan
memengaruhi sifat-sifat magnetis atom tersebut.
Teori Model Atom Bohr
Berdasarkan dari hasil percobaan Thomson tentang elektron dan percobaan Rutherford
tentang inti atom, maka seorang ahli fisika Denmark, Niels Bohr mengungkapkan
kaitan antara spektrum atom dengan struktur energi dalam atom. Untuk mengungkapkan
kaitan tersebut, maka pada tahun 1913 Bohr mengajukanasumsi/postulat yang
selanjutnya dikenal sebagai postulat Bohr, yaitu:
1.
Di dalam suatu atom elektron-elektron bergerak menurut lintasan dengan
tingkatenergy tertentu, sehingga mereka memiliki energy tertentu pula.
2. Elektron-elektron di
dalam atom berada dalam keadaan stasioner, sehingga tidakakan terjadi pancaran
cahaya selama gerakannya. Suatu elektron dapat berpindah darisuatu energy ke
tingkat energy yang lain. Dalam perpindahannya sejumlah energytertentu (kuanta)
diikutsertakan.
3.
Jika suatu elektron dalam atom menjalani lintasan lengkung atau berada
dalamkeadan stasioner mengakibatkan elektron mempunyai sifat-sifat yang
khas.Contohnya sifat momentum angular harus mempunyai kelipatan bulat dari
h/2.Karena itu momentum angular haruslah nh/2 (n bilangan bulat, h tetapan
Planck).
Model atom Bohr menyertakan gagasan tentang gerakan elektron dalam orbit melingkar,
namun ia memasukkan syarat yang ketat. Tiap elektron dalam atom hidrogen hanya
dapat menempati orbit tertentu, karena tiap orbit memiliki energi tertentu,
energi yang berkaitan dengan gerakan elektron pada orbit yang diizinkan harus
mempunyai nilai yang konstan atau terkuantisasi. Pancaran radiasi dari atom hidrogen
berenergi, dapat dihubungkan dengan jatuhnya elektron dari orbit berenergi tinggi ke orbit yang berenergi lebih rendah, danmemberikan
satu kuantum energy (foton) dalam bentuk cahaya.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada
lintasan-lintasan tertentu yang disebut kulit
elektron atau tingkat energi. Tingkat energi paling rendah adalah
kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor
kulitnya dan semakin tinggi energinya.

Niels Bohr menerangkan
model atomnya berdasarkan teori kuantum untuk menjelaskan spektrum gas
hidrogen. Spektrum garis menunjukkan bahwa elektron hanya menempati
tingkat-tingkat energi tertentu dalam atom.


Bohr menggambarkan atom
hidrogen sebagai elektron yang mengorbit sekeliling inti, seperti bumi
mengelilingi matahari. Keadaan boleh ditempati elektron diberi nomor n=1, n=2,
n=3 dan seterusnya. Selanjutnya oleh Bohr lintasan n=1 dinamakan kulit K, n=2
dinamakan kulit L, n=3 dinamakan kulit M dan seterusnya. Secara teoritis
tingkat energi setiap lintasan bisa dihitung, tetapi dalam percobaan hal ini
hal ini sama sekali tidak mungkin. Oleh karena itu, Bohr hanya dapat menghitung
beberapa sifat elektron dalam atom hidrogen dengan menggunakan teorinya.
Kelebihan dan Kekurangan Teori Atom Bohr
Kelebihan dapat menjelaskan:
·
Keberhasilan teori Bohr terletak pada kemampuannya untuk meramalkan
garis-garis dalam spektrum atom hidrogen
·
Salah satu penemuan adalah sekumpulan garis halus, terutama jika atom-atom
yang dieksitasikan diletakkan pada medan magnet.
Kekurangan :
·
Hanya dapat menjelaskan spektrum atom sederhana (hidrogen), tetapi tidak
dapat menerangkan spektrum atom dengan nomor atom ›1
·
Tidak dapat menjelaskan pengaruh medan magnet dalam atom hidrogen
·
Tidak dapat menjelaskan munculnya garis-garis tambahan dalam spektrum
pancar hidrogen bila diberi medan magnetik.
2.4 SIFAT GELOMBANG BENDA : MEKANISME GELOMBANG
Gelombang adalah gejala
rambatan dari suatu getaran/usikan. Gelombang akan terus terjadi apabila sumber
getaran ini bergetar terus menerus. Gelombang membawa energi dari satu tempat
ke tempat lainnya. Contoh sederhana gelombang, apabila kita mengikatkan satu
ujung tali ke tiang, dan satu ujung talinya lagi digoyangkan, maka akan
terbentuk banyak bukit dan lembah di tali yang digoyangkan tadi, inilah yang
disebut gelombang.
·
Berdasarkan mediumnya gelombang
dibagi dua, yaitu :
a.
Gelombang
Mekanik
Gelombang mekanik adalah
gelombang yang dalam proses perambatannya memerlukan medium (zat perantara) .
Artinya jika tidak ada medium, maka gelombang tidak akan terjadi. Contohnya
adalah Gelombang Bunyi yang zat perantaranya udara, jadi jika tidak ada udara
bunyi tidak akan terdengar.
b.
Gelombang
Elektromagnetik
Gelombang elektromagnetik
adalah gelombang yang dalam proses perambatannya tidak memerlukan medium (zat
perantara). Artinya gelombang ini bisa merambat dalam keadaan bagaimanapun
tanpa memerlukan medium. Contohnya adalah gelombang cahaya yang terus ada dan
tidak memerlukan zat perantara.
·
Berdasarkan
arah getar dan arah rambatnya, dibagi menjadi dua, yaitu :
a.
Gelombang
Transversal
Gelombang
transversal adalah gelombang yang arah getarnya tegak lurus dengan arah
rambatannya. Bentuk getarannya berupa lembah dan bukit.

Arah rambat gelombang di atas adalah ke kiri dan ke kanan,
sedangkan arah getarnya adalah ke atas dan ke bawah. Jadi itulah yang dimaksud
arah rambat tegak lurus dengan arah getarnya. Contohnya adalah gelombang pada
tali yang saya contohkan di atas.
b.
Gelombang Longitudinal
Gelombang
longitudinal adalah gelombang yang arah rambatnya sejajar dengan arah
getarannya. Bentuk getarannya berupa rapatan dan renggangan (Dapat dilihat pada
gambar di bawah).

Arah rambat gelombangnya ke kiri dan ke kanan, dan arah getarnya
ke kiri dan ke kanan pula. Oleh karena itu gelombang ini adalah gelombang
longitudinal yang arah getar dan arah rambatnya sejajar. Contoh gelombang ini
adalah Gelombang bunyi, di udara yang dirambati gelombang ini akan terjadi
rapatan dan renggangan pada molekul-molekulnya, dan saat ada rambatan
molekul-molekul ini juga bergetar. Akan tetapi getaranya hanya sebatas gerak
maju mundur dan tetap di titik keseimbang, sehingga tidak membentuk bukit dan
lembah.
·
Berdasarkan amplitudonya (simpangan
terjauh), dibagi menjadi dua :
a. Gelombang
Berjalan adalah gelombang yang amplitudonya tetap pada setiap titik yang
dilalui gelombang, misalnya gelombang pada tali.
b.
Gelomban Diam adalah
gelombang yang amplitudonya berubah, misalnya gelombang pada senar gitar yang
dipetik.
Sifat-sifat
gelombang
a.
Dipantulkan (refleksi)
Dalam pemantulan gelombang
berlaku hukum pemantulan gelombang, yaitu :
§ Besar sudut datangnya gelombang sama
dengan sudut pantul gelombang.
§ Gelombang datang, gelombang pantul,
dan garis normal terletak pada satu bidang datar.

b.
Dibiaskan
(refraksi)
Pembiasan gelombang adalah
pembelokan arah rambat gelombang karena melalui medium yang berbeda
kerapatannya.

c.
Dipadukan
(interferensi)
Perpaduan gelombang terjadi
apabila terdapat gelombang dengan frekuensi dan beda fase saling bertemu. Hasil
interferensi gelombang akan ada 2, yaitu konstruktif (saling menguatkan) dan
destruktif (saling melemahkan). Interferensi Konstruktif terjadi saat 2
gelombang bertemu pada fase yang sama, sedangkan interferensi destruktif
terjadi saat 2 gelombang bertemu pada fase yang berlawanan.

d.
Dibelokkan/disebarkan
(Difraksi)
Difraksi gelombang adalah
pembelokkan/penyebaran gelombang jika gelombang tersebut melalui celah. Geja
difraksi akan semakin tampak jelas apabila celah yang dilewati semakin sempit.

e.
Dispersi Gelombang
Dispersi adalah penyebaran bentuk gelombang ketika merambat
melalui suatu medium. Dispersi tidak akan terjadi pada gelombang bunyi yang merambat
melalui udara atau ruang hampa. Medium yang dapat mempertahankan bentuk
gelombang tersebut disebut medium nondispersi.
f.
Dispolarisasi (diserap arah getarnya)
Polarisasi adalah peristiwa
terserapnya sebagian arah getar gelombang sehingga hanya tinggal memiliki satu
arah saja. Polarisasi hanya akan terjadi pada gelombang transversal, karena
arah gelombang sesuai dengan arah polarisasi, dan sebaliknya, akan terserap
jika arah gelombang tidak sesuai dengan arah polarisasi celah tersebut.

2.5 PERPUTARAN ELEKTRON (SPIN) DAN PRINSIP PEMBATASAN (PAULI)
·
Perputaran Elektron (Spin)
Bilangann kuantum digambarkan sebagai ketiadaan energi yang dapat dihuni
oleh sebuah elektron. Jadi bilangan kuantum berfungsi untuk menentukan
kedudukan atau posisi elektron dalam suatu atom.
Bilangan kuantum ada 4 jenis yaitu bilangan kauntum utama (n), bilangan
kuantum Azimut (l), bilangan kuantum magnetik (m), dan bilangan kuantum spin
(s). Disini kita hanya akan membahas lebih detail sesuai dengan judul materi
yaitu tentang bilangan kuantum spin (s).
Bilangan
kuantum spin (s) menyatakan arah putaran elektron pada sumbunya selama
mengelilingi inti. Sambil beredar mengitari inti, elektron juga berputar pada
sumbunya. Gerak berputar pada sumbu ini disebut rotasi. Bilangan kuantum spin
ada dua jenis yaitu :
S = +1/2 (searah jarum jam tandanya ↑)
S = -1/2 (berlawanan jarum jam tandanya ↓)
Diambil nilai setengah karena hanya ada dua peluang orientasi,
yaitu atas dan bawah. Dengan demikian, peluang untuk mengarah ke atas adalah
50% dan peluang untuk ke bawah adalah 50%.
Akibatnya satu orbital hanya
dapat ditempati oleh maksimum dua elektron, di mana kedua elektron itu haruslah
mempunyai spin yang berlawanan, sehingga menghasilkan medan magnet
yang berlawanan pula. Medan magnet yang berlawanan ini diperlukan untuk
mengimbangi gaya tolak-menolak listrik yang ada (karena muatan sejenis).
Contoh :

Ada beberapa hal yang perlu diperhatikan, yaitu:
- Sampai saat ini, elektron-elektron baru menempati
subkulit-subkulit s, p, d, dan f. Sedangkan subkulit g, h, dan i belum
terisi elektron.
- Setiap kulit mengandung subkulit sebanyak nomor kulit dan
dimulai dari subkulit yang paling sedikit orbitalnya. Kulit pertama hanya
mengandung subkulit s; kulit ke-2 mengandung s dan p; kulit ke-3
mengandung subkulit s, p, dan d; dan seterusnya.
Pembagian Kulit-kulit Atom

·
Prinsip Pembatasan Pauli
Pada tahun 1928, Wolfgang
Pauli (1900-1958) mengemukakan bahwa “Tidak
mungkin dalam satu atom ada dua elektron yang harga keempat bilangan kuantumnya
sama”. Orbital yang sama akan mempunyai bilangan
kuantum n, l, m yang sama. Dengan demikian, yang dapat membedakan hanya
bilangan kuantum spin (s). Setiap orbital hanya dapat berisi 2 elektron dengan
spin (arah putar) yang berlawanan. Misal, 2 elektron
akan menempati subkulit 1s. Tiga bilangan kuantum pertama akan mempunyai nilai
yang sama (n = 1, l = 0, m = 0). Untuk itu bilangan kuantum yang terakhir,
yaitu bilangan kuantum spin(s) harus mempunyai nilai berbeda (+1/2 atau -1/2)
Dengan kata lain, setiap orbital maksimal hanya dapat
terisi 2 elektron dengan arah spin berlawanan. Sebagai contoh, pengisian
elektron pada orbital 1s digambarkan sebagai berikut.

Mengapa pada satu orbital hanya dapat ditempati
maksimal oleh dua elektron? Karena jika ada elektron ketiga, maka elektron
tersebut pasti akan mempunyai spin yang sama dengan salah satu elektron yang
terdahulu dan itu akan melanggar asas larangan Pauli dengan demikian tidak
dibenarkan. Jumlah elektron maksimal untuk tiap subkulit sama dengan dua kali
dari jumlah orbitalnya. Karena satu orbital hanya ditempati 2 elektron, maka 2
elektron tersebut dibedakan berdasarkan arah putaran (spin) yang berbeda atau
dapat dinyatakan bahwa elektron itu mempunyai bilangan kuantum spin berbeda.
Dengan adanya larangan Pauli ini, maka
elektron yang dapat menempati suatu subkulit terbatas hanya dua kali dari
jumlah orbitalnya. Jumlah maksimum elektron adalah sebagai berikut :
Ø orbital
s maksimal 2 elektron,
Ø orbital
p maksimal 6 elektron,
Ø orbital
d maksimal 10 elektron, dan
Ø orbital
f maksimal 14 elektron,
Contoh soal :
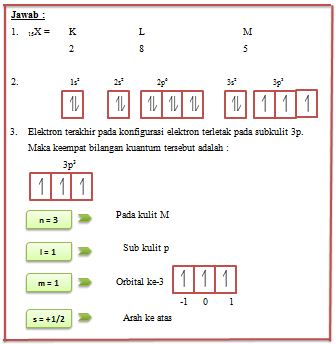
Suatu atom unsur memiliki nomor atom 15. Tentukan :
Konfigurasi elektron berdasarkan uraian kelas 1
Gambaran orbital dari konfigurasi elektron yang telah
anda buat
Ke empat bilangan kuantum dari elektron terakhir pada
konfigurasi elektron
2.6 KONFIGURASI ELEKTRON UNSUR-UNSUR
Konfigurasi elektron adalah susunan penyebaran
(pengisian) elektron-elektron dalam. Didalam atom terdapat partikel subatomik
neutron dan proton yang terdapat pada inti atom, dan elektron yang bergerak
mengelilingi inti atom tersebut pada kulit-kulit elektron (level-level energi)
yang tertentu.
Lintasan peredaran elektron ini disebut juga
kulit elektron. Kulit pertama yang terdekat dengan inti atom disebut kulit K,
kemudian kulit kedua disebut kulit L, kulit ketiga disebut kulit M, dan
seterusnya berurut berdasarkan alfabet sebagaimana kulit menjauhi inti atom.
Kulit elektron ini juga dapat dinyatakan dengan bilangan kuantum utama (n),
dimulai dari 1 untuk kulit K, 2 untuk kulit L, dan seterusnya.
Semakin besar nilai n, semakin jauh kulit
elektron dari inti atom dan semakin besar energi elektron
yang beredar di kulit terkait. Elektron-elektron akan mengisi kulit-kulit
elektron pada atom dimulai dari kulit K yang merupakan level energi terendah.
Setiap kulit elektron hanya dapat terisi sejumlah tertentu elektron. Jumlah
maksimum elektron yang dapat terisi pada kulit elektron ke-n adalah 2n2. Namun,
jumlah maksimum elektron pada kulit terluar dari suatu atom adalah 8. Lebih
jelasnya, perhatikan ilustrasi pada Gambar 1

Gambar 1. Ilustrasi konfigurasi elektron atom
Li, B, O, Ne, Na, dan K berdasarkan kulit elektron

Untuk atom unsur golongan transisi,
konfigurasi elektron nya tidak dapat ditentukan dengan metode penentuan
berdasarkan kulit elektron untuk atom unsur golongan utama seperti di atas.
Penentuan konfigurasi elektron atom unsur golongan transisi didasarkan pada
orbital atom. Setiap orbital dalam atom akan ditandai dengan satu set nilai
bilangan kuantum utama (n), bilangan kuantum azimuth (l), dan bilangan kuantum
magnetik (m) yang khusus. Lalu, setiap orbital maksimum terisi 2 elektron, yang
masing-masing memiliki bilangan kuantum spin (s) tersendiri. Keempat bilangan
kuantum tersebut digunakan untuk men-‘deskripsi’-kan energi elektron,
sebagaimana seperti ‘alamat’ elektron dalam sebuah atom untuk menemukan
keberadaan elektron dalam atom tersebut.
Bilangan kuantum utama (n) mendeskripsikan ukuran dan
tingkat energi orbital. Nilai n yang diperbolehkan adalah bilangan bulat
positif.
Bilangan kuantum azimuth (l) mendeskripsikan bentuk orbital. Nilai l yang diperbolehkan adalah bilangan bulat dari 0 hingga n−1.
Bilangan kuantum magnetik (m) mendeskripsikan orientasi orbital. Nilai m yang diperbolehkan adalah bilangan bulat dari −l hingga +l.
Bilangan kuantum spin (s) mendeskripsikan arah spin elektron dalam orbital. Nilai s yang diperbolehkan adalah +½ atau−½.
Bilangan kuantum azimuth (l) mendeskripsikan bentuk orbital. Nilai l yang diperbolehkan adalah bilangan bulat dari 0 hingga n−1.
Bilangan kuantum magnetik (m) mendeskripsikan orientasi orbital. Nilai m yang diperbolehkan adalah bilangan bulat dari −l hingga +l.
Bilangan kuantum spin (s) mendeskripsikan arah spin elektron dalam orbital. Nilai s yang diperbolehkan adalah +½ atau−½.

Aturan penentuan konfigurasi elektron berdasarkan
orbital:
1. Asas Aufbau: Elektron menempati orbital-orbital dimulai
dari tingkat energi yang terendah, dimulai dari 1s, 2s, 2p, dan seterusnya.

Gambar 2. Urutan tingkat energi subkulit
2. Asas larangan Pauli: Tidak ada dua elektron dalam satu
atom yang memiliki keempat bilangan kuantum yang sama. Setiap orbital maksimum
diisi oleh 2 elektron yang memiliki spin yang berlawanan.
3. Kaidah Hund: Jika ada orbital dengan tingkat energi yang
sama, konfigurasi elektron dengan energi terendah adalah dengan jumlah elektron
tak berpasangan dengan spin paralel yang paling banyak.

Gambar 3. Diagram orbital dan konfigurasi elektron
berdasarkan orbital dari 10 unsur pertama
Contoh Soal Konfigurasi Elektron
Tentukan konfigurasi elektron dan jumlah elektron dalam
setiap kulit elektron atom unsur berikut.
a. Ni (Z =
28) b. Sr(Z = 38)
Jawab:
Ni (Z = 28) : 1s2 2s2 2p6 3s2 3p6 4s2 3d8 atau
[Ar] 4s2 3d8; K = 2 ; L = 8 ; M = 16 ; N = 2
Sr (Z = 38) : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
4p6 5s2 atau [Kr] 5s2; K = 2 ; L = 8 ; M
= 18 ; N = 8 ; O = 2
Berdasarkan eksperimen, terdapat anomali
konfigurasi elektron dari aturan-aturan di atas. Subkulit d memiliki tendensi
untuk terisi setengah penuh atau terisi penuh.
Contohnya, Cr (Z = 24) : [Ar] 4s1 3d5 lebih
stabil dibanding [Ar] 4s2 3d4 ; dan juga Cu (Z
= 29) : [Ar] 4s1 3d10 lebih stabil dibanding
[Ar] 4s2 3d10.
Untuk ion monoatomik (seperti Na+, K+, Ca2+, S2-, Br–)
dapat ditentukan dari konfigurasi elektron atom netralnya terlebih dahulu. Pada
kation (ion bermuatan positif) monoatomik Ax+ yang bermuatan x+, sebanyak
x elektron dilepas (dikurangi) dari kulit elektron terluar atom netral A. Pada
anion (ion bermuatan negatif) monoatomik By– yang bermuatan y-, sebanyak y
elektron ditangkap (ditambahkan) pada orbital level energi terendah yang masih
belum penuh oleh elektron.
2.7 SUSUNAN BERKALA DAN KONFIGURASI ELEKTRON
·
Susunan Berkala
Susunan berkala disebut juga sebagai sistem periodik unsur. Dengan ilmu
kimia kita dapat mempelajari segala sesuatu tentang unsur-unsur dan interaksi
antara suatu unsur dengan unsur yang lainnya, sehingga dapat terjadi suatu
perubahan kimia (reaksi kimia persenyawaan dan lain-lain).
Seperti kita ketahui, telah dikenal lebih dari 100 unsur terdapat di alam
dan masing-masing unsur memiliki sifat-sifat yang berbeda. Oleh karena itu untuk
mempelajari kelakukan setiap unsur, perlu diadakan klasifikasi unsur-unsur
dalam golongan-golongan yang didasarkan atas persamaan sifat-sifatnya.
Unsur-unsur yang memiliki sifat-sifat yang mirip dimasukan ke dalam satu
golongan, sehingga dapat dipelajari dengan lebih mudah dan lebih sistimatis,
sekaligus dapat melihat hubungan antara satu hal dengan hal lainnya. Secara
singkat, guna susunan berkala adalah untuk meramalkan dan mengetahui sifat
unsur, sehingga kita dapat meramalkaan dan mengetahui berbagai gejala/kejadian
di alam.
·
Konfigurasi Elektron
Konfigurasi elektron 20 unsur pertama dalam Sistem Periodik
1. Periode
Periode ditempatkan pada lajur horizontal dalam sistem periodik modern.
Periode suatu unsur menunjukan suatu nomor kulit yang sudah terisi elektron (n
terbesar) berdasarkan konfigurasi elektron. Konfigurasi elektron adalah
persebaran elektron dalam kulit-kulit atomnya.
Dalam sistem periodik modern terdapat 7 periode, yaitu :
1.
Periode 1 (periode sangat pendek) berisi 2 unsur, yaitu H dan He.
2. Periode 2 (periode
pendek) berisi 8 unsur yaitu, Li, Be, B, C, N, O, F, Ne.
3. Periode 3 (periode
pendek) berisi 8 unsur, yaitu Na, Mg, Al, Si, P, S, Cl, Ar.
4. Periode 4 (periode
panjang) berisi 18 unsur, yaitu K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn,
Ga, Ge, As, Se, Br, Kr.
5. Periode 5 (periode
panjang) berisi 18 unsur, yaitu Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd,
In, Sn, Sb, Te, I, Xe.
6. Periode 6 (periode
sangat panjang)berisi 32 unsur yaitu, 18 unsur seperti pada periode 4 atau
ke-5, yaitu Cs, Ba, La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At,
Rn, dan 14 unsur lagi merupakan deret lantanida, yaitu Ce, Pr, Nd, Pm, Sm, Eu,
Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
7.
Periode 7 (periode sangat panjang) berisi 28 unsur, yaitu Fr, Ra, Ac, Rf,
Db, Sg, Bh, Hs,Mt, Uun, Uuu, Uub, Uut, Uuq, Uup, Uuh, Uus Uuobelum lengkap
karena maksimum 32 unsur. Pada periode ini terdapat deret aktinida yaitu Th,
Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
2. Golongan
Golongan adalah lajur tegak pada tabel periodik unsur. Unsur-unsur yang ada
dalam satu lajur tegak adalah unsur-unsur segolongan, terdapat delapan golongan
utama dan delapan golongan transisi.
a. Golongan utama
Golongan utama tersebut adalah :
1.
Golongan I A disebut golongan alkali (kecuali H) terdiri dari unsur-unsur :
H, Li, Na, K, Rb, Cs, Fr .
2.
Golongan II A disebut golongan alkali tanah yang terdiri dari unsur-unsur :
Be, Mg, Ca, Sr, Ba, Ra.
3.
Golongan III A disebut golongan baron aluminium yang terdiri dari
unsur-unsur:
B, Al, Ga, In, Ti, Uut.
4.
Golongan IV A disebut golongan karbon-silicon yang terdiri dari unsur-unsur
:
C, Si, Ge, Sn, Pb, Uuq.
5.
Golongan V A disebut golongan nitrogen-fosforus yang terdiri dari
unsur-unsur:
N, P, As, Sb, Bi, Uup.
6.
Golongan VI A disebut golongan oksigen-belerang yang terdiri dari
unsur-unsur:
O, S, Se, Te, Po, Uuh.
7.
Golongan VII A disebut golongan halogen yang terdiri dari unsur-unsur :
F, Cl, Br, I, At.
8.
Golongan VIII A disebut golongan gas mulia yang terdiri dari unsur-unsur :
He, Ne, Ar, Kr, Xe, Rn.
b. Golongan transisi
Golongan transisi tersebut adalah :
a.
Golongan I B terdiri dari unsur-unsur Cu, Ag, Au, Rg.
b. Golongan II B terdiri
dari unsur-unsur Zn, Cd, Hg, Uub.
c. Golongan III B terdiri
dari unsur-unsur Se,Y, La, Ac.
d. Golongan IV B terdiri
dari unsur-unsur Ti, Zr, Hf, Rf.
e. Golongan V B terdiri
dari unsur-unsur V, Nb, Ta, Db.
f. Golongan VI B terdiri
dari unsur-unsur Cr, Mo, W, Sg.
g. Golongan VI B terdiri
dari unsur-unsurMn, Te, Re,Bh.
h.
Golongan VIII B terdiri dari unsur-unsur Fe, Ru, Os, Hs, Co, Rh, Ir, Mt,
Ni, Pd, Pt, Ds.
Pada periode 6 dan 7 terdapat masing-masing 14 unsur yang disebut
unsur-unsur transisi dalam, yaitu unsur-unsur antanida dan aktinida.
Unsur-unsur transisi dalam semua termasuk golongan IIIB. Unsur-unsur lantanida
pada periode 6 golongan IIIB, dan unsur-unsur aktinida pada periode 7 golongan
IIIB. Penempatan unsur-unsur tersebut di bagian bawah tabel periodik adalah
untuk alasan teknis, sehingga daftr tidak terlalu panjang.
2.8 BENTUK ORBITAL ATOM
Bentuk orbital ditentukan oleh subkulit dari
elektron atau ditentukan bilangan kuantum azimutnya. Jadi, apabila suatu elektron
memiliki bilangan kuantum azimut sama, maka bentuk orbitalnya juga sama,
sehingga yang membedakan hanyalah tingkat energinya. Bentuk orbital merupakan
fungsi Ψ2 dari fungsi gelombang Schrödinger. Sedangkan
orientasi orbital terkait dengan bilangan kuantum magnetik (m).

Macam – macam bentuk orbital yaitu sebagai
berikut.
a.
Orbital s
Orbital yang paling sederhana adalah orbital
s. Setiap subkulit s terdiri atas 1 buah orbital yang berisi 2 elektron.
Orbital s berbentuk bola simetri yang menunjukkan bahwa elektron memiliki
kerapatan yang sama, jika jarak dari inti atom juga sama. Semakin jauh letak
elektron dari inti atom, kerapatannya semakin rendah. Nilai bilangan kuantum
utama suatu orbital memengaruhi ukuran orbital. Semakin besar nilai bilangan
kuantum utama, ukuran orbitalnya juga semakin besar.

b.
Orbital p
Bentuk orbital p seperti balon terpilin
(cuping-dumbbell). Kepadatan elektron tidak tersebar merata, melainkan
terkonsentrasi dalam dua daerah yang terbagi sama besar dan terletak pada dua
sisi berhadapan dari inti yang terletak di tengah.
Subkulit p terdiri atas 3 orbital, tiap
orbital mempunyai bentuk yang sama. Perbedaan ketiga orbital terletak pada
arah, di mana terkonsentrasinya kepadatan elektron. Biasanya orbital p
digambarkan menggunakan satu kumpulan sumbu x, y, dan z, sehingga diberi tanda
px, py dan pz.

Pada subkulit p ini terdapat 3 nilai m (–1,
0, +1) sehingga terdapat 3 orientasi yang satu dan lainnya membentuk sudut
90 o.

c.
Orbital d
Orbital d memiliki 5 orbital dengan bentuk
yang kompleks dan orientasi yang berbeda. Empat orbital pertama memiliki bentuk
yang sama, sedangkan satu orbital memiliki bentuk yang berbeda. Kelima orbital
itu adalah dxy, dxz, dyz, dx2y2, dan dz2.
Untuk lebih jelas, perhatikan gambaran
orbital subkulit d di bawah ini.

Setiap orbital mempunyai 4 “lobe” kepadatan
elektron. Adapun perbedaannya terletak pada arah berkumpulnya kepadatan
elektron. Sementara itu, satu orbital lagi mempunyai bentuk berbeda, tetapi
memiliki energi yang sama dengan keempat orbital d lainnya.
d.
Orbital f
Orbital f mempunyai bentuk orbital yang lebih
rumit dan lebih kompleks daripada orbital d. Setiap subkulit f mempunyai 7
orbital dengan energi yang setara.

Orbital f (mempunyai 7 orbital) dan
dikelompokan menjadi tiga kelompok, yaitu : [1]
·
kelompok pertama : fxyz
·
kelompok kedua : fx(z2 -
y2), fy(z2 - x2),
fz(x2 - y2)
·
kelompok ketiga : fx3, fy3, fz3
Orbital ini hanya digunakan untuk unsur-unsur
transisi yang letaknya lebih dalam.
Materi Kimia :
Materi Kimia :

Distribusi kerapatan elektron dalam orbital 1s, 2s, dan 3s dalam suatu atom. Bila suatu area banyak titiknya menunjukkan kerapatan elektron tinggi. Sedangkan daerah dalam ruang dengan tidak adanya kebolehjadian ditemukan elektron disebut simpul.
2.9 PERBEDAAN SIFAT DIKAITKAN DENGAN STRUKTUR
ATOM
Konsep atom itu dikemukakan oleh
Demokritos yang tidak didukung oleh eksperimen yang meyakinkan, sehingga tidak
dapat diterima oleh beberapa ahli ilmu pengetahuan dan filsafat. Pengembangan
konsep atom-atom secara ilmiah dimulai oleh John Dalton (1805), kemudian
dilanjutkan oleh Thomson (1897), Rutherford (1911), dan disempurnakan oleh Bohr
(1914). Hasil eksperimen yang memperkuat konsep atom ini menghasilkan gambaran
mengenai susunan partikel-partikel tersebut di dalam atom. Gambaran ini
berfungsi untuk memudahkan dalam memahami sifat-sifat kimia suatu atom.
Gambaran susunan partikel-partikel dasar dalam atom disebut model atom.
A.
Model
Atom Dalton
·
Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi
lagi.
·
Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki
atom-atom yang identik dan berbeda untuk unsur yang berbeda.
·
Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat
dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom
oksigen.
·
Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali
dari atomatom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Hipotesis Dalton digambarkan dengan model atom sebagai bola pejal seperti
bola tolak peluru.
B.
Model
Atom Thomson
Atom adalah bola padat bermuatan positif dan di
permukaannya tersebar elektron yang bermuatan negatif. Kelemahan dari Dalton diperbaiki oleh JJ. Thomson,
eksperimen yang dilakukannya tabung sinar katoda. Hasil eksperimennya menyatakan
ada partikel bermuatan negatif dalam atom yang disebut elektron. Suatu bola
pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan
positif sehingga atom bersifat netral.
Kelemahan
model Thomson ini tidak dapat
menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut
C.
Model
Atom Rutherford
Atom adalah bola berongga yang tersusun dari inti atom dan elektron yang
mengelilinginya. Inti atom bermuatan positif dan massa atom terpusat pada inti
atom.
Kelemahan dari Rutherford tidak dapat menjelaskan mengapa elektron tidak
jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari
inti ini disertai pemancaran energi sehingga lama- kelamaan energi elektron
akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke
dalam inti.
D.
Model
Atom Niels Bohr
Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron
yang bermuatan negatif di dalam suatu lintasan.
·
Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap
atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.
Jika berpindah lintasan ke lintasan yang lebih tinggi, elektron akan menyerap
energi. Jika beralih ke lintasan yang lebih rendah, elektron akan memancarkan
energi.
·
Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu yang
disebut kulit-kulit elektron.
E.
Model
Atom Modern
Kulit-kulit elektron bukan kedudukan yang pasti dari suatu elektron, tetapi
hanyalah suatu kebolehjadian saja.
Daftar Pustaka
Kanginan, Marthen. 2011. PHYSICS
for Senior High School Bilingual. Jakarta : Erlangga.
Alfatah, Arif. 2009. Bahas Tuntas 1001 Soal Fisika.
Yogyakarta : Pustaka Widyatama.
Setiono, Budi. 2011. Bahas Total. Jakarta Selatan :
KAWAHmedia
▷ Best casino site in Canada, 2021
BalasHapusLearn about the best online casino site in 카지노 Canada, plus หาเงินออนไลน์ other popular games, bonuses, games, safety, security, & more.Top Casino · Bonuses · Mobile 인카지노