REVIEW
KIMIA DASAR
PERTEMUAN
KE-1 2
NAMA
: LUFITA
NIM
: A1C217021
DOSEN
PENGAMPU : Dr. YUSNELTI, M.Si
PRODI PENDIDIKAN MATEMATIKA
JURUSAN
MATEMATIKA DAN IPA
FAKULTAS
KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS
JAMBI
2017
BAB
1
PENDAHULUAN
1.1
Latar Belakang
Molekul terdiri dari sejumlah atom yang bergabung melalui ikatan kovalen,
dan atom tersebut berkisar dari jumlah yang sangat sedikit(dari atom tunggal,
seperti gas mulia) sampai jumlah yang sangat banyak (seperti pada polimer,
protein atau bahkan DNA). Bentuk molekul, yang berarti cara atom
tersusun di dalam ruang, mempengaruhi banyak sifat-sifat fisika dan kimia
molekul tersebut. Kebanyakan molekul mempunyai bentuk yang didasarkan kepada
lima bentuk geometri yang berbeda.
Molekul-molekul di dalam berikatan, mengacu pada beberapa aturan dan
bentuk-bentuk ikatan kimia. Apabila molekul ingin berikatan harus sesuai dengan
aturan-aturan atau syarat-syarat unsur-unsur tersebut dalam membentuk sebuah
molekul. Karena tidak sembarang suatu unsure membentuk molekul.
Ikatan kimia adalah ikatan yang terjadi antar atom atau antar molekul.
Ikatan kimia itu sendiri bertujuan agar mencapai kestabilan dalam suatu unsur.
Ketika atom berinteraksi untuk membentuk ikatan kimia, hanya bagian terluarnya
saja yang bersinggungan dengan atom lain. Oleh karena itu, untuk mempelajari
ikatan kimia kita hanya perlu membahas elektron valensi dari atom-atom yang
terlibat dalam ikatan kimia tersebut.
1.2
Tujuan
Ø Mengetahui
proses pembentukan ikatan kovalen dan struktur molekul
Ø Mengetahui
bentuk molekul
Ø Mengetahui
teori perputaran berpasangan elektron kulit valensi
Ø Mengetahui
kepolaran molekul dan struktur molekul
Ø Mengetahui
orbital yang tumpang tindih dan ikatan kovalen
Ø Mengetahui
orbital hibrida dan struktur molekul
Ø Mengetahui
ikatan rangkap
Ø Mengetahui
struktur resonansi
Ø Mengetahui
ikatan tunggal di bandingkan ikatan rangkap : struktur
Ø Mengetahui
molekul unsur non logam
BAB
2
PEMBAHASAN
2.1
PEMBENTUKAN IKATAN KOVALEN DAN STRUKTUR MOLEKUL
Ikatan kovalen dapat terjadi karena adanya
penggunaan elektron secara bersama. Apabila ikatan kovalen terjadi maka kedua
atom yang berikatan tertarik pada pasangan elektron yang sama. Molekul hidrogen
H2 merupakan contoh pembentukan ikatan kovalen.
Masing-masing atom hidrogen mempunyai 1 elektron dan untuk mencapai konfigurasi oktet yang stabil seperti unsur golongan gas mulia maka masing-masing atom hidrogen memerlukan tambahan 1 elektron. Tambahan 1 elektron untuk masing-masing atom hidrogen tidak mungkin didapat dengan proses serah terima elektron karena keelekronegatifan yang sama. Sehingga konfigurasi oktet yang stabil dpat dicapai dengan pemakaian elektron secara bersama. Proses pemakaian elektron secara bersama terjadi dengan penyumbangan masing-masing 1 elektron ari atom hidrogen untuk menjadi pasangan elektron milik bersama. Pasangan elektron bersama ditarik oleh kedua inti atom hidrogen yang berikatan.
Masing-masing atom hidrogen mempunyai 1 elektron dan untuk mencapai konfigurasi oktet yang stabil seperti unsur golongan gas mulia maka masing-masing atom hidrogen memerlukan tambahan 1 elektron. Tambahan 1 elektron untuk masing-masing atom hidrogen tidak mungkin didapat dengan proses serah terima elektron karena keelekronegatifan yang sama. Sehingga konfigurasi oktet yang stabil dpat dicapai dengan pemakaian elektron secara bersama. Proses pemakaian elektron secara bersama terjadi dengan penyumbangan masing-masing 1 elektron ari atom hidrogen untuk menjadi pasangan elektron milik bersama. Pasangan elektron bersama ditarik oleh kedua inti atom hidrogen yang berikatan.
2.1.1 Pembentukan Ikatan Kovalen
Ikatan kovalen biasanya terjadi antar unsur
nonlogam yakni antar unsur yang mempunyai keelektronegatifan relatif besar.
Ikata kovalen juga terbentuk karena proses serah terima elektron tidak mungkin
terjadi. Hidrogen klorida merupakan contoh lazim pembentukan ikatan kovalen
dari atom hidrogen dan atom klorin. Hidrogen dan klorin merupakan unsur
nonlogam dengan harga keelektronegatifan masing-masing 2,1 dan 3,0. Konfigurasi
elektron atom hidrogen dan atom klorin adalah
H : 1
Cl : 2 8 7
Berdasarkan aturan oktet yang telah diketahui maka atom hidrogen kekurangan 1 elektron dan atom klorin memerlukan 1 elektron untuk membentuk konfigurasi stabil golongan gas mulia. Apabila dilihat dari segi keelektronegatifan, klorin mempunyai harga keelektronegatifan yang lebih besar dari hidrogen tetapi hal ini tidak serta merta membuat klorin mampu menarik elektron hidrogen karena hidrogen juga mempunyai harga keelektronegatifan yang tidak kecil. Konfigurasi stabil dapat tercapai dengan pemakaian elektron bersama. Atom hidrogen dan atom klorin masing-masing menyumbangkan satu elektron untuk membentuk pasangan elektron milik bersama.
H : 1
Cl : 2 8 7
Berdasarkan aturan oktet yang telah diketahui maka atom hidrogen kekurangan 1 elektron dan atom klorin memerlukan 1 elektron untuk membentuk konfigurasi stabil golongan gas mulia. Apabila dilihat dari segi keelektronegatifan, klorin mempunyai harga keelektronegatifan yang lebih besar dari hidrogen tetapi hal ini tidak serta merta membuat klorin mampu menarik elektron hidrogen karena hidrogen juga mempunyai harga keelektronegatifan yang tidak kecil. Konfigurasi stabil dapat tercapai dengan pemakaian elektron bersama. Atom hidrogen dan atom klorin masing-masing menyumbangkan satu elektron untuk membentuk pasangan elektron milik bersama.
Proses Pembentukan Ikatan Kovalen
Untuk menggambarkan proses pembentukan ikatan
kovalen diperlukan struktur lewis. Berikut ini adalah contoh proses
pembentukan ikatan kovalen dari senyawa H2 dan H2O berikut ini.
·
Proses Pembentukan Ikatan Kovalen Pada
Senyawa H2
Konfigurasi elektron dari 1H = 1
Atom H akan stabil jika mengikat satu elektron
membentuk konfigurasi elektronmirip dengan atom He (2). Satu elektron ini dapat
diperoleh dengan cara saling memasangkan elektron dari dua atom H, sehingga
dengan menggunakan rumus lewis, pembentukan senyawa H2 digambarkan sebagai
berikut:

Pada gambar struktur lewis H2 di atas, setiap atom H
memiliki dua elektron valensi (seperti He) yang digunakan secara bersama-sama.
Dua elektron valensi ini disebut dengan pasangan elektron ikatan (PEI). Karena
molekul H2 sudah mencapai kaidah duplet maka molekul ini sudah stabil.
·
Proses Pembentukan Ikatan Kovalen Pada
Senyawa H2O
Konfigurasi elektron 1H = 1
Konfigurasi elektron 8O = 2, 6
Atom O akan stabil jika mengikat dua elektron membentuk
konfigurasi mirip dengan aton Ne (2, 8) sesuai aturan oktet. Sedangkan
atom H akan stabil jika mengikat satu elektron membentuk konfigurasi mirip He
(2).
Sehingga untuk membentuk ikatan, atom O harus memasangkan
dua elektron valensinya kepada dua atom H dan dua atom H memasangkan
masing-masing satu elektron valensi terhadap dua elektron O tersebut. Dengan
menggunakan struktur lewis, proses pembentukan senyawa H2O digambarkan sebagai
berikut:

Pada gambar struktur lewis H2O di atas, setiap atom H
memiliki 2 elektron valensi (seperti He) dan atom O memiliki 8 elektron valensi
(seperti Ne). Karena sudah mencapai kaidah oktet-duplet maka senyawa ini sudah stabil. Pada ikatan kovalen
ini terdapat dua pasang elektron ikatan (PEI) dan dua pasang elektron bebas
(PEB).
2.1.2 Struktur Molekul
Struktur molekul adalah penggambaran
ikatan-ikatan unsur atau atom yang membentuk molekul. Molekul terdiri dari
sejumlah atom yang bergabung melalui ikatan kimia, baik itu ikatan kovalen,
ikatan hidrogen dan ikatan ion, serta ikatan-iktan kimia lainnya. Dan atom
tersebut berkisar dari jumlah yang sangat sedikit(dari atom tunggal, seperti
gas mulia) sampai jumlah yang sangat banyak (seperti pada polimer, protein atau
bahkan DNA). Bentuk molekul, yang berarti cara atom tersusun di dalam
ruang, mempengaruhi banyak sifat-sifat fisika dan kimia molekul tersebut.
Kebanyakan molekul mempunyai bentuk yang didasarkan kepada lima bentuk geometri
yang berbeda.
Molekul-molekul di dalam berikatan, mengacu pada beberapa
aturan dan bentuk-bentuk ikatan kimia. Apabila molekul ingin berikatan harus
sesuai dengan aturan-aturan atau syarat-syarat unsur-unsur tersebut dalam
membentuk sebuah molekul. Karena tidak sembarang suatu unsure membentuk
molekul.
Sebagai contoh dibawah ini adalah bentuk struktur molekul
dari H2O, CH4, dan NaCl
Molekul didefinisikan sebagai sekelompok atom
(paling sedikit dua) yang saling berikatan dengan sangat kuat (kovalen) dalam susunan
tertentu dan bermuatan netral serta cukup stabil. Menurut definisi ini, molekul
berbeda dengan ion poliatomik. Dalam kimia organik dan biokimia,
istilah molekul digunakan secara kurang kaku, sehingga molekul organik dan biomolekul bermuatan
pun dianggap termasuk molekul.
Dalam teori kinetika gas, istilah molekul sering digunakan untuk
merujuk pada partikel gas apapun tanpa bergantung pada komposisinya. Menurut
definisi ini, atom-atom gas mulia dianggap
sebagai molekul walaupun gas-gas tersebut terdiri dari atom tunggal yang tak
berikatan.
Sebuah molekul dapat terdiri atom-atom yang berunsur sama (misalnya oksigen O2),
ataupun terdiri dari unsur-unsur berbeda
(misalnya air H2O).
Atom-atom dan kompleks yang berhubungan secara non-kovalen (misalnya terikat
oleh ikatan hidrogen dan ikatan ion)
secara umum tidak dianggap sebagai satu molekul tunggal.
Rumus Struktur
Rumus empiris sebuah
senyawa menunjukkan nilai perbandingan paling sederhana unsur-unsur penyusun senyawa tersebut. Sebagai contohnya, air selalu memiliki nilai perbandingan atom hidrogen berbanding oksigen 2:1. Etanol pula selalu memiliki nilai perbandingan
antara karbon, hidrogen,
dan oksigen 2:6:1.
Namun, rumus ini tidak menunjukkan bentuk ataupun susunan atom dalam molekul
tersebut. Contohnya, dimetil eter juga memiliki nilai perbandingan yang sama
dengan etanol. Molekul dengan jumlah atom penyusun yang sama namun berbeda susunannya disebut
sebagai isomer.
Perlu diperhatikan bahwa rumus empiris hanya memberikan
nilai perbandingan atom-atom penyusun suatu molekul dan tidak memberikan nilai
jumlah atom yang sebenarnya. Rumus molekul menggambarkan
jumlah atom penyusun molekul secara tepat. Contohnya, asetilena memiliki
rumus molekuler C2H2, namun rumus empirisnya adalah CH.
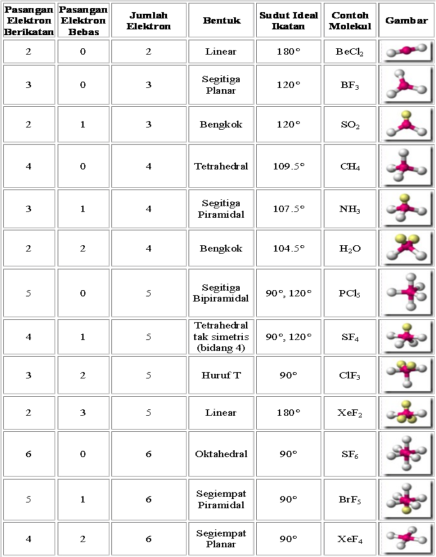
2.2 BENTUK MOLEKUL

Domain berarti wilayah atau daerah. Domain
elektron berarti suatu wilayah yang ditempati oleh elektron. Adapun elektron
yang dimaksud di sini adalah elektron dari atom-atom pembentuk molekul, meliputi
pasangan elektron bebas (PEB) dan pasangan elektron ikatan (PEI). Sebuah
molekul memiliki bentuk atau struktur yang berbeda dengan struktur molekul
lain. Bentuk molekul berarti cara atom tersusun di dalam ruang. Bentuk molekul
ini banyak memengaruhi sifat-sifat fisis dan kimia dari molekul tersebut,
khususnya dalam reaksi kimia. Ketika dua molekul dicampurkan untuk bereaksi,
ada kemungkinan reaksi tidak berhasil dikarenakan struktur tiga dimensi dan
orientasi relatif molekul-molekul tersebut tidak tepat. Dalam reaksi biologi,
terutama pada obat dan aktivitas enzim, struktur molekul sangat penting untuk
mengetahui kecocokan antara bentuk molekul dengan tapak atau membran yang
dipakai.
Bentuk molekul adalah gambaran tentang
susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron
dalam atom atau molekul, baik pasangan elektron yang bebas maupun yang
berikatan. Bentuk suatu molekul dapat diperkirakan berdasarkan teori tolakan
pasangan elektron maupun teori hibridisasi. Bagaimanakah bentuk suatu molekul
berdasarkan teori tersebut? Perhatikan uraian berikut.
1. Teori Tolakan Pasangan Elektron
Konsep yang dapat menjelaskan bentuk geometri (struktur
ruang) molekul dengan pendekatan yang tepat adalah Teori Tolakan Pasangan
Elektron Valensi (Valence Shell Electron Pair Repulsion = VSEPR). Teori ini
disebut juga sebagai Teori Domain Elektron. Teori Domain dapat menjelaskan ikatan antar atom dari
PEB dan PEI yang kemudian dapat mempengaruhi bentuk molekul. Dalam teori
ini dinyatakan bahwa “pasangan elektron terikat dan pasangan elektron bebas,
yang secara kovalen digunakan bersama-sama di antara atom akan saling menolak,
sehingga pasangan itu akan menempatkan diri sejauh-jauhnya untuk meminimalkan
tolakan”. Teori VSEPR pertama kali dikembangkan oleh ahli kimia dari Kanada,
R.J. Gillespie (1957). Bentuk molekul dan strukturnya dapat diramalkan dengan
tepat melalui Struktur Lewis. Struktur ini dapat menggambarkan bagaimana
elektron tersusun pada suatu atom yang berikatan. Sebagat contoh adalah ikatan
kovalen pada molekul HC1 (Gambar 1). Struktur Lewis juga dapat menggambarkan
jumlah pasangan elektron bebas dan jumlah pas-angan elektron ikatan yang berada
di sekitar atom pusat.

Gambar 1. PEI dan PEB pada ikatan kovalen molekul
HCl.
|
Teori VSEPR tidak menggunakan orbital atom
dalam meramalkan bentuk molekul, tetapi menggunakan titik elektron suatu atom.
Jika suatu atom bereaksi, maka elektron pada kulit terluar (elektron valensi)
akan bcrhubungan langsung terlebih dahulu. Elektron valensi akan menentu-kan
bagaimana suatu ikatan dapat terjadi.
Teori VSEPR menjelaskan terjadinya gaya tolak-menolak
antara pasangan-pasangan elektron pada kulit terluar atom pusat.
Pada setiap orbital terdapat sejumlah
elektron. Ikatan antar atom terjadi karena kecenderungan atom untuk memenuhi
rumus duplet dan rumus oktet. Duplet berarti mcmiliki 2 elektron, scdangkan
oktrt menandakan suatu atom memiliki 8 elektron. Bagaimana cara meramalkan
bentuk molekul dengan titik elektron? Pengaturan pasangan elektron di sekitar
atom sedemikian rupa sehingga tolakan di antara pasangan elektron itu minimum.
Tolakan minimum tcrjadi bila elektron terletak pada bagian yang saling
bcrlawanan terhadap inti. Perhatikan molekul BeC12 pada Gambar 2.
 |
Gambar 2. Bentuk molekul BeC12 berupa
linear.
|
Terdapat 2 elektron yang terletak berlawanan pada orbital
berupa balon terpilin. Molekul BeC12 berbentuk linear dengan sudut
1800. Bagaimana dengan b
entuk molekul lain, semisal SO2 dan
BC13? Perhatikan Gambar 3. dan 4.
 |
Gambar 3. Bentuk molekul SO2 berupa V.
|
lkatan kovalen adalah ikatan yang terjadi karena
pemilikan bersama pasangan elektron berikatan yang merupakan sum-bangan dari
kedua atom atau salah satunya.
 |
Gambar 4. Bentuk molekul BC13 berupa
segitiga datar.
|
Teori VSEPR berhasil menjelaskan bentuk molekul.
Ketepatan daya prediksi teori VSEPR relatif sangat tinggi, khususnya untuk
molekul-molekul yang pusatnya atom non-logam.
Mengapa struktur SO2 berbeda dengan
struktur BeC12? Mengapa pula berbeda dengan struktur BC13. Penjelasan
berikut akan memberikan jawabannya.
Tolakan minimum didapat dengan meletakkan elektron pada
bagian yang berlawanan. Tolakan minimum pada mulekul BC13 dengan atom
B sebagai atom pusat didapat dengan bentuk segitiga. Adapun pada
molekul SO2 terdapat 3 kelompok elektron, yang salah satunya adalah
PEB dari atom S. Adanya elektron bebas ini akan mendesak atau mendorong elekron
ikatan untuk saling berdesakan, sehingga bentuk molekul menjadi bentuk V.
Urutan tolak-menolak antara pasangan elektron pada atom
pusat dapat diurutkan sebagai: PEB-PEB > PEI-PEB > PEI-PEI.
PEB mempunyai gaya tolak-menolak sejauh mungkin sehingga
tolakannya minimum. Perbedaan kekuatan tolakan PEB dan PEI menyebabkan
penyimpangan dalam susunan ruang elektron dari bentuk molekul yang seharusnya.
Apabila pada molekul BC12 atom pusat B
dinotasikan dengan M, sedangkan ikatan dengan Cl yang terjadi dengan 2 pasang
elektron ikatan dinotasikan dengan X2, maka
molekul BC12 dan molekul sejenis dinotasikan dengan MX2.
SO2 dinotasikan dengan MX2E, dengan E menunjukkan jumlah
pasangan pa sangan elektron bebas. Notasi semacam ini disebut sebagai notasi
VSEPR. Perhatikan notasi VSEPR dan bentuk molekul beberapa senyawa pada Tabel
1.
Cara Menentukan
Bentuk Molekul Berdasarkan Teori VSEPR
·
Tentukan atom pusatnya.
·
Cari tahu nomor atomnya dan buat konfigurasi
elektronnya.
·
Tentukan jumlah elektron valensinya.
·
Tentukan jumlah domain elektron dari atom
lain yang berikatan (ligan).
·
Jumlahkan elektron dari semua atom.
·
Bagilah dua untuk mendapatkan jumlah pasangan
elektron.
·
Tentukan PEI berdasarkan jumlah atom yang
terikat pada atom pusat, sisanya merupakan PEB.
·
Tentukan notasi VSEPR dan bentuk molekul
berdasarkan jumlah PEB dan PEI (lihat tabel 1. sebagai acuan).
2. Teori Domain Elektron
Teori domain elektron merupakan penyempurnaan dari
teori VSEPR. Domain elektron berarti kedudukan elektron atau daerah
keberadaan elektron, dengan jumlah domain ditentukan sebagai berikut (Ralph H.
Petrucci, 1985).
Setiap elektron ikatan (baik itu ikatan tunggal, rangkap,
atau rangkap tiga) berarti 1 domain.
Setiap pasangan elektron bebas berarti 1 domain.

2.3 TEORI PERPUTARAN BERPASANGAN ELEKTRON KULIT VALENSI
Salah satu tujuan utama teori ikatan kimia
adalah untuk menerangkan dan memperkirakan struktur molekul. Teori yang memperlihatkan
kemudahan dalam konsepnya dan memberikan hasil yang memuaskan dalam
kemampuannya memperkirakan bentuk geometrimolekul yang tepat disebut teori
perputaran berpasangan elektron Wit valensi(valence shell electron pair
repulsion theory—VSEPR theory). Teori ini tidak menggunakan same
sekali orbital atom. Kite lihat sebagai penggantinya adalah bile struktur
titik elektron dapat digambar untuk suatu molekul, maka bentuk umum molekul
tersebut dapat diperkirakan.
Bila kita ingin mengetahui bentuk suatu
molekul, kite cari caranya untuk menentukan bagaimana atom atau sekelompok atom
(biasanya untuk ini digunakan istilah ligan) tersusun mengelilingi atom
pusat. Sebagai contoh, dalam molekul S02, bagaimana atom oksigen
(ligan) diatur mengelilingi atom beleran~? Apakah ketiga atom tersebut pads
satu garis lurus (disebut molekul Tinier) atau terikat membentuk sudut kurang
dari 180°?. Untuk menjawab pertanyaan ini, teori VSEPR menunjukkan bahwa
pengaturan geometri ligan sekeliling atom pusat ditentukan hanya oleh
perputaran pasangan elektron dikulit valensi atom pusat. Menurut teori tersebut
pasangan elektron dianggap dalam posisi dimana perputaran di antara elektron An
minimum dan ligan mengikuti perputaran tersebut. Untuk mengetahui bagaimana
caranya, marilah kita mulai dengan memperhatikan molekul BeC12 yang
sederhana.Struktur-titik elektronnya seperti ini
CI~Be:CI
Molekul khusus ini, memenuhi rumus oktet, jadi hanya ada
dua pasang elektron dikulit valensi Be. Menurut teori VSEPR, pasangan
elektron ini akan mengatur sendiri letaknya sejauh mungkin, sehingga
perputaran antar elektron tersebut minimum. Bila ada dua pasang elektron
pada kulit valensi, perputaran minimum ini terjadi bila elektron terletak
ada bagian yang berlawanan dalam inti.
Dalam molekul BeCl, ligan (dalam hal ini atom
klor) melekat pada Be, dengan membagi sama pasangan elektron tersebut. Ini
berarti klor harus ditempatkan dimana pasangan elektron tersebut
berada. Dengan demikian struktur molekul adalah linear.
Dalam kenyataannya, bentuk molekul BeC12 adalah
gas.
Kita dapat juga mempelajari hal ini lebih lanjut dengan
mempelajari ikatan rangkap dua dan rangkap tiga. Misalnya
molekul CO2 mempunyai struktur titik sebagai berikut
dimana terlihat ada ikatan rangkap antara atom C dan O.
Kedua pasang elektron pada ikatan rangkap harus berada pada daerah yang
sama di kulit valensi atom, bila tidak, ikatan itu bukan ikatan
rangkap. Oleh, sebab itu, dilihat dari akibat penentuan menurut
geometri molekul, kelompok empat elektron pada ikatan rangkap mempunyai sifat
yang hampir sama dengan kelompok dua elektron pada ikatan. tunggal. Oleh sebab
itu pada kulit valensi karbon, kita mempunyai dua kelompok 'empat
elektron dan kelompok ini terletak pada tempat yang berlawanan dari inti
karbon, jadi perputaran di antara elektronnya minimum seperti sebelumnya, ligan
(dalam hal ini oksigen) melekat pada atom pusat dengan bantuan pasangan
elektron ini dan kita peroleh lagi struktur yang tinier.
2.4 KEPOLARAN MOLEKUL DAN STRUKTUR MOLEKUL
Pasangan elektron yang digunakan secara
bersama pada pembentukan ikatan kovalen yang terletak diantara dua inti atom
akan ditarik oleh kedua inti atom yang berikatan. Akibatnya akan mempengaruhi
distribusi elektron di antara kedua inti yang berikatan. Kemampuan menarik
elektron kearah dirinya tergantung pada keelektronegatifan masing-masing unsur
yang berikatan.
Untuk molekul unsur, seperti H2, Cl2 dan
N2 ikatan kovalen yang terbentuk seratus persen bersifat kovalen. Hal ini
disebabkan kedua inti atom memiliki kemampuan yang sama untuk menarik elektron
ke arah dirinya, sehingga elektron ikatan akan terdistribusi secara merata di
antara kedua inti, seperti yang ditunjukan pada Gambar. Ikatan yang terbentuk dengan kemampuan menarik
pasangan elektron yang sama kuat disebut ikatan kovalen nonpolar.

Gambar gambar Penyebaran elektron pada ikatan kovalen
nonpolar Cl-Cl
Apabila kedua atom yang berikatan berbeda misalnya pada
HF, HCl dan HI, maka ikatan yang terbentuk tidak sepenuhnya bersifat kovalen.
Hal ini yang dinamakan ikatan kovalen polar. Dikatakan ikatan kovalen polar
karena kedua atom yang berikatan terdapat gaya elektrostatik.
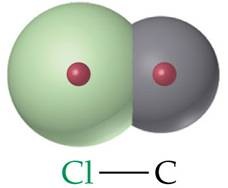
Gambar Ikatan kovalen polar C-Cl
Berdasarkan perbedaan kelektronegatifan, suatu
ikatan kovalen dikatakan ikatan kovalen polar apabila
suatu atom mampu menarik elektron ikatan ke arah dirinya tanpa
melakukan perpindahan secara sempurna.
Semakin besar perbedaan keelektronegatifan
unsur-unsur yang berikatan, semakin polar ikatan yang terbentuk bahkan
mendekati sifat ionik. HX (X = Cl, Br, I, F), H2O, CO2, CCl4, BeCl2,
BeCl3 dan NH3 merupakan beberapa contoh senyawa dengan ikatan kovalen
polar. Misalnya HCl, meskipun atom H dan Cl sama-sama menarik pasangan
elektron ikatan, tetapi keelektronegatifan Cl lebih besar dari atom H sehingga
distribusi elektron ikatan lebih terkonsentrasi pada Cl.
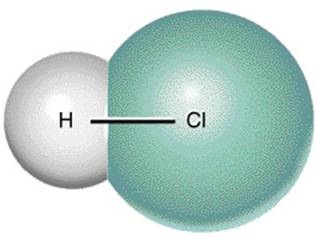
Gambar ikatan kovalen polar H-Cl
Molekul Polar dan Nonpolar
Suatu senyawa yang memiliki ikatan kovalen
polar, belum tentu molekul yang dimiliki bersifat polar. Demikian juga untuk ikatan kovalen nonpolar,
molekul yang dimiliki belum tentu bersifat nonpolar. Kepolaran suatu molekul
dinyatakan menggunakan suatu besaran yang disebut momen dipol (µ). Besarnya
momen dipol suatu molekul ditentukan menggunakan persamaan berikut.
µ = Q x r 1 D = 3,33 x 10-30 C.m (coulombmeter)
µ = 0 → molekul nonpolar
µ > 0 atau µ ≠ 0 → molekul polar
keterangan:
µ = momen dipol (D, debye)
Q = selisih muatan (Coulomb)
r =
jarak antara muatan positif dengan muatan negatif
(m)
Semakin besar harga momen dipol, semakin polar senyawa
yang bersangkutan bahkan mendekati ke sifat ionik. Harga momen dipol beberapa
molekul seperti yang tertera pada
Tabel.
molekul
|
Momen dipol (D)
|
molekul
|
Momen dipol (D)
|
NO
NH3
HF
HCl
HBr
HI
H2O
|
0,159
0,23
1,78
1,078
0,82
0,44
1,85
|
CO
CO2
CHCl3
CH4
CCl4
BF3
BF2
|
0,112
0
1,09
0
0
0
0
|
Momen dipol merupakan suatu besaran vektor yang
digambarkan menggunakanmoment ikatan. Jika jumlah vektor momen-momen
ikatan lebih besar dari nol, maka molekul tersebut bersifat polar, sebaliknya
jika jumlah vektor momen-momen ikatan sama dengan nol, maka maka molekul
tersebut bersifat nonpolar.
Momen ikatan terbentuk jika dua atom yang berikatan dalam
suatu senyawa memiliki perbedaan keelektronegatifan. Elektron yang yang ditarik oleh atom yang lebih
elektronegatif menunjukan arah momen ikatan dan ditunjukan menggunakan tanda →
dari atom yang kurang elektronegatif menuju atom yang lebih elektronegatif.
Akibat tarikan elektron yang terjadi, terbentuk semacam
kutub negatif pada atom yang lebih elektronegatif, sedangkan pada atom yang
kurang elektronegatif akan terbentuk semacam kutub positif.
Kutub positif atau negatif yang terbentuk
disebut muatan parsial, yang digambarkan menggunakan simbol delta
(δ). Muatan parsial negatif (δ¯) diberikan pada unsur yang lebih elektronegatif
dan muatan parsial positif (δ+) diberikan pada unsur yang kurang elektronegatif
(lebih elektropositif).
Berikut contoh menggambar muatan parsial pada molekul
HCl.

Dari contoh di atas terlihat bahwa terdapat muatan
positif dan negatif pada tanda δ yang digunakan. Tanda tersebut tidak sama dengan +1 atau -1 seperti
pada simbol ion, tetapi tanda ini hanya menggambarkan elektron ikatan tidak
sepenuhnya dipindahkan ke atom Cl.
Untuk senyawa diatom yang disusun oleh unsur yang
sejenis, molekul yang dimiliki selalu bersifat nonpolar kecuali ozon yang
bersifa polar. Hal ini disebabkan dua atom penyusun senyawa memiliki
keelektronegatifan sama sehingga tidak terbentuk momen ikatan. Sedangkan untuk
senyawa diatom yang disusun oleh dua atom yang berbeda molekul yang dimiliki
selalu bersifat polar karena adanya perbedaan keeltronegatifan.
Tetapi untuk senyawa-senyawa yang tersusun lebih
dari dua atom, kepolaran molekul tidak dapat ditentukan jika hanya didasarkan
pada perbedaan keelektronegatifan. Hal ini disebabkan senyawa-senyawa
tertentu walaupun memiliki ikatan kovalen polar tetapi molekulnya bersifat
nonpolar. Misalnya CCl4, CO2 dan BeCl2 merupakan beberapa senyawa
dengan ikatan kovalen polar tetapi memiliki molekul yang nonpolar.
Pada molekul CCl4, yang mempunyai bentuk molekul
tetrahedaral dengan C sebagai atom pusat dan dikelilingi oleh 4 atom Cl seperti
pada Gambar.

Perbedaan keelektronegatifan C dan Cl adalah
sebesar 3-2,5 = 0,5. Jadi
ikatan C–Cl termasuk ikatan kovalen (tepatnya ikatan kovalen polar) karena
perbedaan keeltronegatifan lebih kecil 1,7. Walaupun ikatan C–Cl berupa ikatan
kovalen polar tetapi molekulnya bersifat nonpolar.
Hal ini disebabkan, bentuk tetrahedral dari molekul
CCl4 dapat dikatakan simetrism karena memiliki pusat simetri pada atom C
ditengah, sehingga jumlah momen ikatan yang sama dengan nol. Atau dapat dikatan
tarikan elektron akibat adanya perbedaan keelektronegatifan saling meniadakan
atau saling menguatkan (perhatikan tanda panah pada strutur). Hal ini dapat diandaikan, suatu benda yang berada
di tengah-tengah ditarik dari empat sudut dengan kekuatan sama, maka benda
tersebut tidak akan bergerak. Karena hal inilah molekul CCl4 bersifat
nonpolar.
Jika CCl4 salah satu atom Cl diganti oleh atom lain
misalnya H, maka sifat molekul yang awalnya nonpolar berubah menjadi polar. Hal
ini disebabkan kepolaran ikatan C-H berbeda dengan kepolaran ikatan C-Cl,
sehingga momen dipol yang terbentuk tidak saling meniadakan. Tetapi apabila
semua atom C diganti oleh atom H maka molekulnya bersifat nonpolar karena
kepolaran semua ikatan C–H sama besar sehingga mpmen ikatan yang terbentuk
saling meniadakan.
Pada molekul BCl2 dan CO2 mempunyai bentuk
molekul linear dengan B dan C sebagai atom pusat.
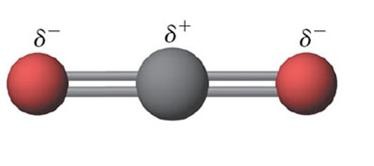
Atom Cl dan atom O lebih elektronegatif dibanding atom B
dan C yang bertindak sebagai atom pusat (pada gambar yang berwarna hitam),
sehingga elektron ikatan lebih tertarik kearah atom Cl dan O. Namun, atom B dan
C masing-masing mengikat 2 atom yang sejenis maka momen ikatan yang terbentuk
tertarik ke arah yang berlawanan dengan kekuatan yang sama, sehingga molekulnya
bersifat nonpolar.
Molekul H2O walaupun rumus molekulnya mirip dengan
CO2 dan BCl2 tetapi bersifat polar.
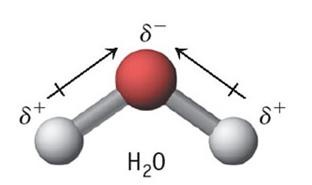
Hal ini disebabkan, pada molekul H2O, atom O sebagai atom
pusat masih memiliki pasangan elektron bebas. Hal ini menyebabkan molekul H2O tidak berbentuk
linear seperti molekul CO2 dan BCl2, sehingga momen ikatan yang terbentuk
tidak saling menguatkan atau tidak saling meniadakan.
2.5 ORBITAL YANG TUMPANG TINDIH DAN IKATAN KOVALEN
Pembentukan ikatan kovalen dapat dijelaskan
menggunakan dua teori yaitu teori ikatan valensi dan teori orbital molekul.
Berdasarkan teori ikatan valensi, ikatan kovalen dapat
terbentuk jika terjadi tumpang tindih orbital valensi dari atom yang berikatan.
Orbital valensi merupakan orbital terluar dari suatu atom dan merupakan tempat
terletaknya elektron valensi. Orbital valensi inilah yang digunakan pada
pembentukan ikatan kimia.
Dua atom yang saling mendekati masing-masing
memiliki orbital valensi dan satu elektron. Orbital valensi ini saling tumpang
tindih sehingga elektron yang terletak pada masing-masing orbital valensi
saling berpasangan. Sesuai
larangan Pauli maka kedua elektron yang berpasangan tersebut harus memiliki
spin yang berlawanan karena berada pada satu orbital. Dua buah
elektron ditarik oleh inti masing-masing atom sehingga terbentuk ikatan
kovalen. Untuk penjelasan selanjutnya orbital valensi disebut orbital saja.
Orbital dari dua buah atom yang salng tumpah tindih harus
memiliki tingkat energi yang sama atau perbedaan tingkat energinya.
Pembentukan katan kovalen menggunakan orbital asli
Dua
jenis orbital yang digunakan dalam pembentukan ikatan kovalen yaitu orbital
asli dan orbital hibridisai.jenis orbital yang digunakan dalam
pembentukan ikatan kovalen dapat diramalkan berdasarkan geometri, terutama
besar sudut ikatan yang ada disekitar atom pusat. Berikut beberapa molekul yang
terbentuk menggunakan orbital asli.
Contoh H2S

Dari konfigurasi elektron atom S pada keadaan dasar dapat
diketahui bahwa pada orbital 2py dan orbital 2pz masing-masing masih kekurangan
satu elektron, demikian pula pada atom H masih kekurangan satu elektron pada
orbital 1s. Oleh sebab
itu dalam pembentukan H2S, dua elektron yang terletak pada orbital 3p
berpasangan dengan dengan dua elektron pada orbital 1s dari dua atom hidrogen.
Besarnya sudut ikatan dua buah orbital p adalah 90°.
Berdasarkan eksperimen diperoleh besarnya sudut ikatan H-S-H sebesar 92°.
Perbedaan sudut ikatan disebabkan oleh tolakan antara dua inti atom hidrogen
yang berdekatan. Karena perbedaan sudut ikatan tidak begitu jauh maka
pembentukan ikatan H-S, atom S dianggap menggunakan orbital-orbital asli.
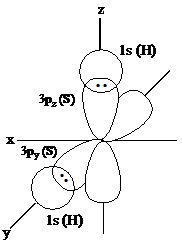
Gambar tumpang tindih orbital-orbital pada pembentukan
ikatan H-S dalam molekul H2S
Contoh HCl

Dari konfigurasi elektron atom Cl pada keadaan dasar
dapat diketahui bahwa pada orbital 2pz masih kekurangan satu elektron, demikian
pula pada atom H masih kekurangan satu elektron pada orbital 1s. Oleh sebab itu
dalam pembentukan H2S, dua elektron yang terletak pada orbital 3p berpasangan
dengan dengan dua elektron pada orbital 1s dari dua atom hidrogen.
Oleh sebab itu dalam pembentukan HCl, satu elektron yang
terletak pada orbital 3pz berpasangan dengan dengan satu elektron pada orbital
1s dari satu atom hidrogen.
Molekul HCl berbentuk lenear dan memiliki sebuah ikatan
tunggal, sehingga molekul HCl menggunakan orbital asli dalam pembentukan ikatan
H-Cl.

Gambar tumpang tindih orbital-orbital atom pada
pembentukan ikatan H-Cl dalam molekul HCl
2.6 ORBITAL HIBRIDA DAN STRUKTUR MOLEKUL
Hibridisasi adalah konsep pencampuran orbital
atom menjadi orbital hibrida yang sesuai dengan pasangan elektron untuk
membentuk ikatan kimia. orbital hibrida biasanya mempunyai perbedaaan energi
dan bentuk. Hibridisasi orbital berguna untuk menjelaskan struktur molekuler
ketika teori ikatan valensi gagal untuk menjelaskannya.
Karbon merupakan contoh yang baik untuk penjelasan orbital hibrida. Konfigurasi atom
karbon dalam keadaan ground state adalah
Berdasarkan teori ikatan valensi, karbon
seharusnya membentuk ikatan kovalen, menghasilkan CH2 karena karbon mempunyai
dua elektron tak berpasangan secara konfigurasi elektron. Meskipun demikian
melalui eksperimen dapat ditunjukkan bahwa CH2 bersifat sangat reaktif dan
tidak dapat terbentuk setelah akhir reaksi (meskipun hal ini nuga tidak
menjelaskan bagaimana CH4 dapat terbentuk). Untuk membentuk empat ikatan,
konfigurasi karbon harus mempunyai empat elektron tidak berpasangan.
Dengan demikian karbon telah mempunyai empat
elektron tidak berpasangan, sehingga mempunyai empat energi ikatan yang sama.
Hibridisasi orbital juga lebih disukai karena mempunyai energi yang lebih kecil
dibandingkan dengan orbital terpisah. Hal tersebut menghasilkan senyawa yang
lebih stabil ketika terjadi hibridisasi dan ikatan yang terbentuk juga lebih
baik.
Jenis jenis hibridasi
Terdapat tiga jenis hibridisasi orbital, yaitu sp3, sp2
dan sp.
·
Hibridisasi sp3
Dapat menjelaskan struktur molekul tetrahedral. Orbital
2s dan tiga orbital 2p melakukan hibridisasi untuk membentuk empat orbital sp,
masing-masing terdiri dari 75% karakter p dan 25% karakter s. Cuping depan
mensejajarkan diri dan penolakan elektron bersifat lemah.
Orbital sp3 membentuk tetrahedral (a) dan metana adalah
contoh senyawa dengan hibridisasi sp3 (b).
Hibridisasi satu orbital s dengan tiga orbital p (px, py,
pz) menghasilkan empat orbital hibrida sp3 yang mempunyai sudut sebesar 109,5
derajat satu sama lain sehingga membentuk geometri tetrahedral.
·
Hibridisasi sp2
Menjelaskan bentuk struktur molekul trigonal planar.
Orbital 2s dan dua orbital 2p melakukan hibridisasi membentuk tiga orbital sp,
amsing-masing terdiri dari 67% karakter p dan 33% karakter s. Cuping depan
mensejajarkan diri membentuk trigonal planar, menghadap sudut segitiga untuk
meminimalisasi penolakan elektron.
Gambar orbital sp2 tampak samping (kiri) dan tampak atas
(kanan)
Hibridisasi satu orbital s dan dua orbital p menghasilkan
tiga orbital hibrida sp2 yang berorientasi dengan sudut sebesar 120 derajat
satu sama lain sehingga membentuk geometri trigonal.
·
Hibridisasi sp
Menjelaskan struktur molekul linear. Orbital 2s dan satu
orbital 2p melakukan hibridisasi membentuk dua orbital sp, masing-masing
terdiri dari 50% karakter p dan 50% karakter s.
Cuping depan berhadapan satu sama lain dan membentuk
garis lurus 180 derajat antara dua orbital.
2.7 IKATAN RANGKAP
Ikatan rangkap adalah ikatan kimia yang terbentuk
dari penggunaan bersama dua atau tiga pasang elektron (setiap atom yang
berikatan memberikan dua atau tiga elektron valensi untul digunakan secara
bersama-sama). Dengan demikian jumlah PEI ada;ah dua atau tiga.
Jenis-Jenis Ikatan Kovalen Rangkap
Dari pengertian ikatan kovalen rangkap di
atas, jumlah pasangan elektron ikatan yang digunakan bersama-sama adalah dua
atau tiga sehingga dari definisi tersebut menunjukkan bahwa ikatan kovalen
rangkap ada dua macam yaitu ikatan kovalen rangkap dua dan ikatan
kovalen rangkap tiga. Dengan demikian dapat kita simpulkan bahwa :
Ikatan kovalen rangkap dua adalah ikatan yang terbentuk
dari penggunaan bersama dua pasang elektron (jumlah pasangan PEI ada 2) oleh
dua atom yang berikatan sedangkan kovalen rangkap tiga adalah ikatan yang
terbentuk dari penggunaan bersama tiga pasang elektron (jumlah pasangan PEI ada
3).
Proses Pembentukan Ikatan kovalen Rangkap
Untuk menggambarkan proses pembentukan ikatan
kovalen rangkap baik rangkap dua maupun rangkap tiga, kita dapat
menggunakan struktur lewis. Gas O2 dan CO2 secara lebih spesifik adalah jenis
molekul yang berikatan kovalen rangkap dua.
Sedangkan contoh molekul yang berikatan kovalen rangkap
tiga dapat kita temui pada gas nitrogen (N2). Untuk lebih jelas mengenai proses
pembentukan ikatan rangkap pada tiga senyawa tersebut, perhatikan contoh
berikut ini
·
Proses Pembentukan Ikatan Kovalen Rangkap 2
pada Molekul O2
8O
|
=
|
2, 6
|
(memerlukan 2 elektron untuk mencapai kaidah oktet)
|
Berdasarkan konfigurasi elektron atom O di atas, maka
atom O akan stabil jika konfigurasi elektronnya serupa dengan 10Ne = 2, 8
sehingga mencapai kaidah oktet. Agar stabil maka atom O memerlukan 2 elektron tambahan.
Kedua elektron tambahan tersebut dapat diperoleh dengan cara patungan 2
elektron valensi dari masing-masing atom O membentuk ikatan kovalen rangkap
dua.
Jika digambarkan dengan struktur lewis maka proses
pembentukan ikatan kovalen rangkap dua pada molekul O2 adalah sebagai
berikut

Jumlah pasangan elektron yang digunakan bersama (PEI)
antara dua atom O adalah 2 pasang (4 elektron) yang digambarkan dalam bentuk
dua garis rumus bangun lewis dimana dua garis mewakili dua pasang elektron.
Karena jumlah PEI adalah dua maka molekul O2 dikatakan berikatan secara
kovalen rangkap dua.
·
Proses Pembentukan Ikatan Kovalen Rangkap 3
pada Molekul N2
Molekul N2 tersusun atas dua atom N dengan
konfigurasi elektron sebagai berikut:
7N
|
=
|
2, 5
|
(memerlukan 3 elektron untuk mencapai kaidah oktet)
|
Berdasarkan konfigurasi elektron atom N di atas, maka
atom N akan stabil jika konfigurasi elektronnya serupa dengan 10Ne = 2, 8.
Agar stabil maka atom N memerlukan 3 elektron tambahan. Kedua elektron tambahan
tersebut dapat diperoleh jika dua atom N saling berikatan dimana setiap atom N
menyumbangkan 3 elektron untuk digunakan bersama sehingga masing-masing atom N
mencapai kaidah oktet.
Proses pembentukan ikatan kovalen rangkap tiga pada
molekul N2 dapat digambarkan dalam struktur lewis sebagai berikut

Perhatikan gambar struktur lewis pada proses pembentukan
molekul N2 di atas. Jumlah pasangan elektron yang digunakan bersama (PEI)
antara dua atom N adalah 3 pasang (6 elektron) yang digambarkan dalam bentuk
tiga garis rumus bangun lewis dimana tiga garis mewakili tiga pasang elektron.
Karena jumlah PEI adalah tiga maka molekul N2dikatakan berikatan secara kovalen
rangkap tiga.
2.8 STRUKTUR RESONANSI
Ketika menggambar struktur Lewis untuk ozon
(O3) aturan oktet untuk atom O pusat dipenuhi dengan menempatkan ikatan rangkap
dua di antara atom O pusat dan salah satu dari dua atom O ujung. Kenyataannya,
kita dapat meletakkan ikatan rangkap dua tersebut pada salah satu ujung
molekul, oleh kedua struktur Lewis yang ekuivalen berikut:

Tetapi, kedua struktur Lewis ini tidak dapat menjelaskan
panjang ikatan yang sudah diketahui dalam O3.
Berdasarkan strukur di atas, ikatan O—O dalam
O3 diperkirakan akan lebih panjang daripada ikatan O=O, karena ikatan
rangkap dua telah diketahui lebih pendek dibandingkan ikatan tunggal. Tetapi
data percobaan menunjukkan bahwa panjang kedua ikatan oksigen-dengan-oksigen
adalah sama panjang (128 pm). Masalah ini diatasi dengan menggunakan kedua
struktur Lewis untuk menyatakan molekul ozon:

Kedua struktur itu masing-masing disebut
sebagai struktur resonansi (resonance structure). Dengan
demikian, struktur resonansi adalah salah satu dari dua atau
lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan secara
tepat dengan hanya menggunakan satu struktur Lewis. Tanda panah dua arah
menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi.
Istilah resonansi berarti penggunaan
dua atau lebih struktur Lewis untuk menggambarkan molekul tertentu. Seperti
seorang Eropa pada abad pertengahan yang melakukan perjalanan ke Afrika, yang
menjelaskan bahwa badak adalah hasil persilangan
antara griffin dan unicorn, dua binatang yang terkenal tetapi
hanya khayalan, kita menggambarkan ozon yang merupakan molekul nyata, dalam dua
struktur yang terkenal tetapi tidak nyata.
Konsep resonansi juga berlaku dengan baik
untuk senyawa-senyawa organik. Contoh yang baik adalah molekul benzena (C6H6):

Jika salah satu dari struktur resonansi di atas terkait
dengan struktur benzena yang sesungguhnya, maka akan terdapat dua panjang
ikatan yang berbeda antara atom-atom C yang berdekatan, satu ikatan dengan
panjang ikatan yang khas untuk ikatan tunggal dan satu ikatan dengan panjang
ikatan yang khas untuk ikatan rangkap dua. Kenyataannya, semua atom C yang
berdekatan pada benzena panjanganya 140 pm, yang lebih pendek dari ikatan
tunggal, C—C (154 pm) dan lebih panjang dari ikatan rangkap dua , C=C (133 pm).
Cara sederhana untuk menggambarkan struktur
molekul benzena dan senyawa lain yang mengandung “cincin benzena” adalah dengan
menggambarkan hanya kerangkanya saja tanpa atom C dan H. Berdasarkan
kesepakatan ini, struktur resonansinya digambarkan dengan:

Perhatikan bahwa atom-aton C di setiap sudut segi enam
tersebut dan atom-atom H yang ada tidak ditunjukkan, walaupun sebenarnya
atom-atom tersebut ada. Hanya ikatan antara atom-atom yang ditunjukkan.
Harap diingat ini merupakan anatara penting untuk
menggambarkan struktur resonansi: Posisi elektron dapat diubah-ubah untuk
menghasilkan struktur resonansi yang lain, tanpa mengubah posisi atom-atomnya.
Dengan kata lain, atom-atom yang saling berikatan harus tetap dalam semua
struktur resonansi untuk satu spesi tertentu.
Akhirnya, perhatikan bahwa walaupun suatu ion atau
senyawa dapat digambarkan secara lebih akurat dengan menyertakan semua struktur
resonansinya, tetapi supaya sederhana biasanya hanya satu struktur Lewis saja
yang dipergunakan.
2.9 IKATAN TUNGGAL DIBANDINGKAN DENGAN IKATAN RANGKAP :
STRUKTUR
2.9.1 Ikatan tunggal
Ikatan kovalen tunggal adalah ikatan kovalen
yang melibatkan penggunaan 1 pasangan elektron (2 elektron) oleh dua atom yang
saling berikatan. Dengan kata lain, hanya terdapat 1 pasangan elektron ikatan.
Penggunaan pasangan elektron dalam ikatan kovalen dapat digambarkan dengan
struktur Lewis. Struktur Lewis menggambarkan jenis atom-atom dalam molekul dan
caranya atom-atom tersebut terikat satu sama lain. contoh : Ikatan yang terjadi
pada HF.
Contoh Soal :
1. Tuliskan pembentukan ikatan yang terjadi pada zat-zat
berikut.
a. Antara atom 1H dan 6C pada senyawa CH4
Solusi 1a.
Konfigurasi elektron 1H: 1 sehingga elektron valensinya =
1. Untuk mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet),
diperlukan 1 elektron. 6C: 2,4 sehingga elektron valensinya =4. Untuk mencapai
konfigurasi elektron yang stabil (sesuai kaidah oktet), diperlukan 4 elektron.
Maka struktur lewis pembentukan CH4:
2.9.2 Ikatan Kovalen Rangkap
Ikatan kovalen rangkap adalah ikatan kovalen
yang melibatkan penggunaan bersama 2 pasangan elektron (4 elektron) oleh dua
atom yang saling berikatan. Dengan kata lain, terdapat dua pasangan elektron
ikatan.
Contoh : Pembentukan ikatan pada molekul O2
Contoh : Pembentukan ikatan pada molekul O2
Contoh Soal:
1. Tuliskan pembentukan ikatan yang terjadi pada molekul
CO2.
solusi :
6C: 2,4 sehingga elektron valensinya =4. Untuk mencapai
konfigurasi elektron yang stabil (sesuai kaidah oktet), diperlukan 4 elektron.
8O: 2, 6; sehingga elektron valensinya= 6. Untuk mencapai konfigurasi elektron
yang stabil (sesuai kaidah oktet), diperlukan 2 elektron. Maka struktur lewis
pembentukan CO2 dapat juga digambarkan sebagai berikut:
2.9.3 Ikatan Kovalen Rangkap Tiga
Ikatan kovalen rangkap tiga terbentuk jika
terjadi penggunaan bersama 3 pasangan elektron (6 elektron) oleh dua atom yang
berikatan. Dengan kata lain, terdapat tiga pasangan elektron ikatan.
contoh : Pembentukan ikatan yang terjadi pada molekul N2
contoh : Pembentukan ikatan yang terjadi pada molekul N2
2.10 MOLEKUL UNSUR NONLOGAM
Molekul unsur adalah merupakan molekul yang terbentuk dari hasil penggabungan
atom-atom unsur yang sama atau sejenis.
Sebagai contoh, gas O2 (oksigen) yang ada di udara adalah unsur yang partikelnya berupa molekul. Molekul oksigen dibentuk oleh dua atom oksigen (lihat Gambar di bawah ini).
Sebagai contoh, gas O2 (oksigen) yang ada di udara adalah unsur yang partikelnya berupa molekul. Molekul oksigen dibentuk oleh dua atom oksigen (lihat Gambar di bawah ini).
 |
Gambar: Contoh Molekul Unsur Oksigen (O2)
|
Molekul yang terbentuk dari dua atom disebut molekul dwiatom, misalnya Nitrogen (N2). Sedangkan, atom yang terbentuk dari tiga atom atau lebih disebut molekul poliatomik.
Sebagai
contoh, molekul yang dibentuk oleh tiga atom disebut molekul triatom, misalnya Ozon (O3). Molekul
yang terdiri atas empat atom disebut molekul tetraatom, misalnya posfor (P4).
 |
Gambar: Contoh Susunan Atom Molekul
Poliatomik
|
Daftar pustaka
Tidak ada komentar:
Posting Komentar