REVIEW
KIMIA DASAR
PERTEMUAN
KEENAM

NAMA
: LUFITA
NIM
: A1C217021
DOSEN
PENGAMPU : Dr. YUSNELTI, M.Si
PRODI PENDIDIKAN MATEMATIKA
JURUSAN
MATEMATIKA DAN IPA
FAKULTAS
KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS
JAMBI
2017
BAB 1
PENDAHULUAN
1. Latar belakang
Reaksi kimia adalah suatu proses alam yang selalu
menghasilkan antar perubahan senyawa kimia. Senyawa ataupun senyawa-senyawa
awal yang terlibat dalam reaksi disebut sebagai reaktan. Reaksi kimia biasanya
dikarakterisasikan dengan perubahan kimiawi dan akan menghasilkan satu atau
lebih produk yang biasanya memiliki ciri-ciri yang berbeda dari reaktan. Secara
klasik, reaksi kimia melibatkan perubahan yang melibatkan pergerakan elektron
dalm pembentukan dan pemutusan ikatan kimia, walaupun pada dasarnya konsep umum
reaksi kimia juga dapat diterapkan pada transformasi partikel-partikel
elementer seperti pada nuklir. Reaksi-reaksi kimia yang berbeda digunakan
bersama dalam sintesis kimia untuk menghasilkan produk senyawa yang diinginkan.
Oleh karena itu perlu adanya pengamatan dan pencarian informasi baik secara
langsung melihat benda itu maupun mempelajari teori-teorinya untuk memperdalam
hazanah ilmu pengetahuan kita. Sehingga diharapkan kita tidak mudah heran
dengan suatu reaksi yang tidak pernah kita bayangkan akan seperti yang kita
lihat.
2.
Tujuan
·
Mengetahui apa saja reaksi kimia kmia yang terdapat dalam larutan air
·
Mengetahui istilah – istilah yang ada dalam larutan
·
Menegtahui tentang elektrolit
·
Mengetahui reaksi antara ion – ion
·
Mengetahui reaksi asam basa
·
Mengetahui proses terjadinya reaksi metatesis
BAB 2
PEMBAHASAN
2.1 REAKSI KIMIA DALAM LARUTAN AIR
Salah satu pelarut yang paling
penting bagi reaksi kimia adalah air. Air suatu zat yang umum tapi merupakan
pelarut yang baik untuk bermacam zat kimia baik yang berbentuk ion atau
molekul. Malah, kemampuan air untuk melarutkan bermacam zat kimia dalam
berbagai derajat merupakan kekhawatiran pokok dari masyarakat modern sekarang,
yang se-clang bergumul dengan bertambahnya persoalan pencemaran air pada daerah
padat penduduk. Banyaknya perhatian yang telah diberikan pada reaksi dalam
larutan air, sebagian karena air merupakan pelarut umum yang mudah didapat
dalam laboratorium dan sebagian lagi karena adanya reaksi pencemaran air yang
potensial disekeliling kita dan jugs disebabkan karena air merupakan media
dimana reaksi biokimia terjadi.
2.2 ISTILAH-ISTILAH
PADA LARUTAN
Larutan adalah campuran yang bersifat
homogen antara molekul, atom ataupun ion
dari dua zat atau lebih. Disebut campuran karena
susunannya atau komposisinya dapat
berubah. Disebut homogen karena susunanya begitu
seragam sehingga tidak dapat diamati
adanya bagian-bagian yang berlainan, bahkan dengan
mikroskop optis sekalipun.
Fase larutan dapat berwujud gas, padat ataupun cair.
Larutan gas misalnya udara.
Larutan padat misalnya perunggu, amalgam dan paduan
logam yang lain. Larutan cair
misalnya air laut, larutan gula dalam air, dan
lain-lain. Komponen larutan terdiri dari pelarut
(solvent) dan zat
terlarut (solute). Pada bagian ini dibahas larutan cair. Pelarut
cair umumnya adalah air. Pelarut cair yang lain
misalnya bensena, kloroform, eter, dan alkohol.
Banyak istilah yang kita pakai
pada pembicaraan mengenai larutan telah diperkenalkan pada modul Termasuk
istilah pelarut (solven) dan zat terlarut (solut). Solven umumnya adalah zat
yang berada pada larutan dalam jumlah yang besar, sedangkan zat lainnya
dianggap sebagai solut. Pada larutan yang mengandung air maka air tersebut
selalu dianggap sebagai solven walaupun jumlahnya relatif sedikit. Misalnya
pada campuran dari H2SO4 96% dan H2O 4% berat, dinamakan "asam sulfat
pekat", menggambarkan bahwa sejumlah besar asam sulfat dilarutkan dalam
sedikit air, jadi air merupakan solven dan H2SO4 solutnya.
lstilah lain yang adalah pekat dan encer. Canaan
pekat mengandung relatif lebih banyak solut dibanding solven
sedangkan larutan encer mengandung relatif lebih sedikitsolut
dibanding solvennya. Ditekankan di sini kata relatif, sebab ada larutan disebut
pekat bila dibandingkan dengan larutan lain yang mempunyai perbandingan solut
lebih rendah terhadap solvennya. Dalam beberapa hal, ada batas dari jumlah
solut yang dapat lanit dalam sejumlah solven pada temperatur tertentu. Misalnya
bila kita tambahkan natrium klorida pada 100 ml air pada 0°C hanya 35,79 g
garam yang akan larut, berapapun banyaknya jurnlah garam yang kita masulckan.
Kelebihan NaCl rya akan mengendap di dasar wadah.
Larutan dapat dibagi menjadi 3
yaitu sebagai berikut :
1.
Larutan tak jenuh
yaitu larutan yang mengandung solute (zat terlarut) kurang dari yang diperlukan
untuk membuat larutan jenuh. Atau dengan kata lain, larutan yang partikel-
partikelnya tidak tepat habis bereaksi dengan pereaksi (masih bisa melarutkan
zat). Larutan tak jenuh terjadi apabila bila hasil kali konsentrasi ion <
Ksp berarti larutan belum jenuh ( masih dapat larut).
2.
Larutan jenuh yaitu
suatu larutan yang mengandung sejumlah solute yang larut dan mengadakan
kesetimbangn dengan solut padatnya. Atau dengan kata lain, larutan yang partikel-
partikelnya tepat habis bereaksi dengan pereaksi (zat dengan konsentrasi
maksimal). Larutan jenuh terjadi apabila bila hasil konsentrasi ion = Ksp
berarti larutan tepat jenuh.
3.
Larutan sangat jenuh
(kelewat jenuh) yaitu suatu larutan yang mengandung lebih banyak solute
daripada yang diperlukan untuk larutan jenuh. Atau dengan kata lain, larutan
yang tidak dapat lagi melarutkan zat terlarut sehingga terjadi endapan. Larutan
sangat jenuh terjadi apabila bila hasil kali konsentrasi ion > Ksp berarti
larutan lewat jenuh (mengendap).
2.3 ELEKTROLIT
Umumnya air adalah pelarut (solven) yang baik untuk
senyawa ion dan larutan air yang yang mengandung zat-zat ini akan mempunyai
sifat-si fat yang khan, salah satu adalah dapat meneruskan arcs listrik. Dapat
diperlihatkan oleh alai pada Gambar 5.2. Bila elektroda dicelupkan ke dalam air
murni, bola lampu tak akan menyala karena air adalah kon duktor listrik yang
sangat jelek. Tetapi bila suatu senyawa ion yang larut seperti NaCI ditambahkan
pada air, setelah solutnya lanit, bola lampu mulai menyala dengan terang.
Senyawa seperti NaCl yang membuat larutan menjadi konduktor listrik
disebut elektrolit.
Bagaimana keterangan dari sifat konduktor listrik
larutan senyawa ion dalam air ini? Ketika zat larut dalam air, ion-ion yang
tadinya terikat kuat dalam zat padatnya akan lepas dan melayang-layang dalam
larutan, bebas satu dengan yang lain. Dikatakan senyawa telah terdisosiasi atau
melepaskan diri menghasilkan ion-ion dan adanya ion-on bebas inilah yang
menyebabkan larutan menjadi konduktor listrik.
Keterangan mengenai elektrolit ini pertama kali
diberikan oleh Svante Arrhenius , ahli kimia terkeital dari Swedia. Sangatlah
menarik untuk disimak bahwa hampir saja is tak diberikan gelar doktornya pada
tahun 1884 di Universitas Upsala, Swedia, karena mengemukakan hal ini.
Bagaimanapun teorinya tetap bertahan sampai kini, karena telah menerangkan
dengan sukses mengenai sifat larutan garam.
Bila senyawa ion berdisosiasi dalam air, ion-ionnya
tak bebas sama sekali, karena ion-ion tersebut akan dihalangi oleh
molekul-molekul air sehingga dikatakan akan terhidrasi. Hal ini dinyatakan
dengan tulisan (aq) dibelakang dari rumus ion-ion tersebut. Misalnya pada
disosiasiNatrium klorida yang terjadi bila zat padatnya dilarutkan dalam air
dapat atakan dalam persamaan:
NaCl(s) ----> Na+(aq) + CI-(aq)
Kerapkali, untuk mudahnya huruf s dan aq dihilangkan
saja. Terbentuknya ion-ion dalam larutan tak hanya terbatas untuk senya wa ion
saja. Banyak juga zat berbentuk molekul yang bereaksi dengan air akan
menghasilkan ion-ion sehingga juga merupakan suatu elektrolit. Contohnya
adalah HCI. Bila gas HCI dilarutkan dalam air, akan terjadi reaksi sebagai
berikut:
HCI(g) + H20 à H2O +(aq)
+ Cl-(aq)
Reaksi semacam ini biasanya disebut reaksi ionisasi karena
mengha silkan ion-ion yang sebelurnnva tak ada (Tetapi sering disebut sebagai
disosiasi agar tak usah menggunakan istilah yang berbeda untuk elek trolit ion
dan molekul). Reaksi terjadi karena adanya perpindahan pro ton atau ion
hidrogen (H+) dan molekul HCI ke molekul air menghasilkan ion
hidronium H2O+ dan ion klorida (CI-).
Sehingga walaupun hidrogen klorida murni berada sebagai molekul yang
kelistrikannya netral (cairan HCI tak menghantarkan listrik) bila dilarutkan
dalam air akan teqadi reaksi kimia dan menghasilkan ion dan menjadi suatu
elektrolit.
Seperti
terlihat, ion hidronium merupakan sesuatu yang sangat penting untuk dibicarakan
pada reaksi kimia dalam lamtan air. Sangatlah berguna untuk menganggap ion
hidronium itu sebagai ion H+ atau proton yang berasosiasi
dengan molekul air. Kita dapat melakukan hal ini karena bila ion hidronium
bereaksi, akan dilepaskan protonnya dan yang tinggal molekul air sebagai salah
satu hasil reaksi. Sebetulnya H20 dari ion hidronium hanya bertindak
sebagai pembawa untuk ion H+. Karena itu ion hidronium sering
ditulis sebagai H+, dan kita sering
membicarakan ion H30+ sebagai ion hidrogen. Bila H20
dari H30+ ion kita hilangkan, disosiasi HCI dapat
ditulis sebagai berikut:
HCI(aq) à 4 H+(aq) + Cl-(aq)
Walaupun kita menulis hanya H+, harus selalu
diingat bahwa paling sedikit satu tapi mungkin ada beberapa lagi molekul H20
yang berasosi dengan proton ini dalam larutan.
2.3.1 Elektrolit Kuat dan Elektrolit Lemah
Dua contoh elektrolit yang dibicarakan diatas yaitu
NaCl dan HCl, dalam larutan akan terdisosiasi secara sempurna; 1 mol NaCl akan
memberikan 1 mol Na+ dan 1 mol Cl-, demikian juga 1
mol HCl akan menghasilkan 1 mol ion H+dan 1 mol ion Cl-.
Zat-zat semacam NaCI dan HCI yang dalam larutan akan terdisosiasi sempurna
disebut elektrolit kuat.
Banyak juga zat-zat yang berbentuk molekul bila
dilarutkan dalam air yang sama sekali tak mempunyai kemampuan untuk
terionisasi. Contohnya alkohol dan gula. Bila senyawa-senyawa ini dilarutkan
dalam air, molekul-molekulnya hanya bercampur dengan molekul-molekul air
membentuk larutan yang homogen, tetapi larutannya tak mengandung ion-ion karena
solutnya tak bereaksi dengan air. Karena solut ini tak menghasilkan ion dalam
larutan, larutannya tak menghantarkan listrik dan solut semacam ini
dinamakan non elektrolit.
Diantara elektrolit kuat dan nonelektrolit ada
sejumlah senyawa yang disebut elektrolit lemah. Senyawa-senyawa
ini menghasilkan larutan yang menghantarkan listrik, tetapi lemah sekali.
Contohnya asam asetat CH3COOH suatu zat yang membuat cuka rasanya asam. Bila
elektroda dari alas konduktor dicelupkan ke dalam larutan asam ini dari bola
lampu hanya redup saja.
Dalam
larutan asam asetat, hanya sebagian kecil dari molekul asam asetat yang
dihasilkan reaksi berikut ini berbentuk ion
CH3COOH (aq) à CH3COO- (aq) + H+ (aq)
MisaInya dalam larutan CH3COOH 1,0 M hanya kira-kira 0,42% yang bereaksi.
Sisanya masih tetap berbentuk molekul yang tak bermuatan.
Sangatlah penting untuk dibicarakan sebab dari
keterbatasan dari derajat disosiasi elektrolit lemah ini, karena hal ini akan
mengabaikan hal-hal penting dari konsep kimia, sehingga akan diuraikan dalam
modul dibelakang.
Pada larutan asam asetat, molekul-molekul CH3COOH
secara tetap akan bertumbukan dengan molekul air dan setiap tumbukan ada kemungkinan
sebuah proton dari molekul CH3COOHakan berpindah ke molekul air dan
menghasilkan H+ serta CH3COO- ion. Tapi dalam
larutan ini ada juga pertemuan antara ion asetat dan ion hidronium. Bila kedua
ion ini bertemu, kemungkinan besar dari ion H+ akan melepaskan
protonnya ke ion CH3COO- untuk membentuk kembali molekul-molekul
CH3COOHdan H20. Sehingga dalam larutan ini ada dua reaksi yang
berjalan bersamaan
1. CH3COOH + H2O à H+ + CH3COO-
2. H+ + CH3COO- à CH3COOH + H2O
Biila kecepatan reaksi (1) untuk membentuk ion-ion
sama dengan kecepatan reaksi (2) yang menghilangkan ion-ion tersebut, maka
konsentrasi masing-masing zat dalam larutan tak akan berubah. Malah mulai saat
ini konsentrasi masing-masing zat akan tetap, walaupun bila kita teliti ada
beberapa unit CH3COOHyang kadang-kadang berbentuk ion CH3COO- ,
kadang-kadang sebagai molekul CH3COOH. . Keadaan semacam
ini disebut seimbang. Disebut keseimbangan dinamik karena
dalam larutan selalu terjadi perubahan - tedadi dua rekasi: ion-ion bereaksi
menjadi molekul dan molekul bereaksi membentuk ion-ion.
Untuk menunjukkan adanya reaksi kesetimbangan dalam
suatu reaksi, digunakan dua tanda panah == > pada reaksi kimianya. Sehingga,
kesetimbangan yang kita bicarakar, ditulis sebagai berikut:
CH3COOH + H2O == > H+ + CH3COO-
Penggunaan panah dua arah ini menyatakan bahwa kecepatan reaksi dari
kiri ke kananadalah sama dengan kecepatan reaksi dari kanan ke kiri. Dalam
larutan asam asetat kecepatan reaksi yang sama ini terjadi sewaaktu sedikit
asam asetat yang telah terionisasi. Dalam hal semacam ini dikatakan bahwa
larutan asam asetat kecil. Jadi keadaan setimbang yaitu
perbandingan relatif antara pereaksi dan hasil reaksi lebih kuat ke kiri
berarti lebih banyak ke arah bentuk molekul. Dengan kata lain hampir seluruh
asam asetat berada dalam bentuk tak terionisasi.
Untuk elektrolit kuat seperti HCl, reaksi dari
ion-ionnya untuk membentuk molekul kemungkinannya tak ada. Bila ion H+ bertemu
dengan ion Cl- dalam larutan, tak terbentuk apa-apa. Sebab itu bila HCl
dilarutkan dalam air, hanya reaksi ke kanan yang terjadi dan segera seluruh HCl
akan berubah menjadi ion-ion. Solut akan terionisasi 100%. Bila kita menulis
persamaan reaksi untuk elektrolit kuat dalam air, kita hilangkan tanda panah ke
kiri karena reaksinya tak terjadi. Karena itu untuk reaksi HCl ditulis
HCL(aq) + H2) à H+ + Cl -(aq).
2.4 REAKSI ANTARA ION-ION
Banyak
reaksi-reaksi kimia yang dilakukan dalam laboratorium, yang merupakan bagian
dalam pelajaran kimia, melibatkan elektrolit-elektrolit yang dilarutkan dalam
air. Umumnya, reaksi-reaksi ini terjadi antara ion-ion yang ada dalam larutan,
sebab itu dapat disebut reaksi reaksi ion. Contoh yang khas adalah
reaksi yang tedadi bila larutan natrium klorida dan perak
nitrat dicampur, yang diperlihatkan dalam. Ketika larutan yang satu ditambahkan
pada yang lain, suatu. endapan putih dari
perak klorida terbentuk. Bila larutan natrium klorida mengandung 1 mol NaCl dan
larutan perak nitrat mengandung 1 mol AgNO3, Maka 1 mol AgCI
akan terbentuk dan larutan akan menganduilg I mol NaNO3 yang terlarut. Bila
diinginkan, kita dapat memisahkan AgCI dari larutan dengan jalan menyaring
campuran. Bila filtrat, air yang jernih yang melalui kertas
caring, diuapkan, yang tinggal adalah kristal NaNO3. Persamaan kimia untuk perubahan yang terjadi adalah
AgNO,(aq) + NaCI(aq) à AgC1(s) + NaNO,(aq)
Reaksi semacam ini, dimana terjadi pertukaran tempat dari anion dan kation
dinamakan metatesis atau perubahan rangkap, (Cl-
menggantikan NO, - dan NO3 - menggantikan CI-).
Persamaan di atas dinamakan persamaan
molekuler, sebab semua pereaksi dan hasil reaksi ditulis seolah-olah
zat-zat tersebut berbentuk molekul. (Tentunya kamu telah mengetahui bahwa
zat-zat ionik dalam keadaan padat maupun larutan tak berbentuk sebagai molekul.
Dinamakan saja persamaan molekuler karena tak diperlihatkan adanya ion-ion).
Penyajian
yang lebih tepat dari reaksi ini seperti yang terjadi sesungguhnya didapat
bila kita memperhatikan apa yang terjadi bila solut dilarutkan dalam air.
Seperti telah dibicarakan sebelumnya, tiap senyawa ion yang larut, pada larutan
berada bukan dalam bentuk molekul tapi sebagai ion-ion yang tersebar dalam pelarut.
senyawa ini 100% akan terdisosiasi. sebab itu, dalam air NaCl berada dalam
bentuk ion Na+ dan Cl-. Demikian juga larutan AgNO3,
berada sebagai ion Ag+ dan ion NO3 -. Bila kedua larutan
dicampur, eat padat AgCI terbentuk karena bergabungnya ion Ag+ dan ion CI-. Zat
padat dalam larutan yang terbentuk karena reaksi kimia dinamakan suatu endapan. Larutan
yang ada setelah terbentuk AgCI hanya mengandung ion Na+ dan
ion NO3-, jadi adalah
larutan Natrium Nitrat NaNO3. Untuk menunjukkan zat-zat
Yang seluruhnya terdisosiasi dalam reaksi ini kita tulis persamaannya sebagai
berikut:
Ag’(aq)
+ NO, -(aq) + Na-(aq) + C1 (aq)
---> AgCl(.Y) + Na’(aq) + NO3 -(aq)
Persamaan ini disebut persamaan ionik dan didapat
dengan menulis rumus dari tiap elektrolit kuat yang larut dalam bentuk
terdisosiasi dan. rumus "yang tak larut dalam bentuk molekuler".
Bila diperiksa persamaan ionik dari reaksi ini, terlihat
bahwa ion Na+ dan NO3 – tak mengalami perubahan. Ion Na+ dan NO3
- yang sama tetap
2.5 REAKSI ASAM BASA
2.5.1 PENGERTIAN ASAM BASA
Pengertian Reaksi
Asam Basa (Reaksi Penetralan) didalam Ilmu Kimia adalah suatu Reaksi Kimia yang
melibatkan Reagen (Zat atau Senyawa Kimia) Asam dan Reagen Basa yang dapat
menghasilkan Garam dan Air. Reagen Asam yang dipakai dapat berupa Asam
Lemah ataupun Asam Kuat, begitu pula dengan Reagen Basa yang dipakai bisa
berupa Basa Lemah ataupun Basa Kuat.
2.5.2 TEORI ASAM BASA
1. Teori Asam Basa Arrhenius
Teori Asam dan Basa ini dikemukakan oleh Svante August
Arrhenius yang merupakan Seorang Ilmuwan Kimia berasal dari Swedia yang lahir
pada tanggal 19 Februari 1859 sampai 02 Oktober 1927 silam. Svante August
Arrhenius pada tahun 1884 Silam menjelaskan bahwa Kekuatan Asam didalam Air
tergantung pd Konsentrasi Ion – Ion Hidrogen didalam-nya.
Menurut Svante August Arrhenius bahwa Asam adalah Zat
yang jika didalam Air dapat melepaskan Ion Hidrogen (H+), sebenarnya Ion – Ion
Hidrogen yang dihasilkan oleh Asam tersebut ketika dilarutkan didalam Air akan
terkait dengan Molekul – Molekul Air (H2O) dalam bentuk Ion Hidronium yakni Ion
Positif yg dibentuk atas penambahan sebuah Ion Hidrogen (Proton) pada sebuah
Molekul Air.
Namun tidak semua Senyawa Hidrogen itu Asam misalnya
Etanol yang mempunyai Rumus Kimia C2H5OH, walaupun didalam Etanol terdapat
Unsur H namun Etanol bukanlah Asam. Kemudian Asam berdasarkan Kekuataannya
menurut Svante August Arrhenius ini terdiri dari Asam Kuat dan Asam Lemah,
sedangkan jika dilihat dari Jumlah Ion H+ yang dilepaskannya maka dibedakan
menjadi Asam Monoprotik, Asam Diprotik dan Asam Triprotik.
Lalu Teori Asam Basa Menurut Arrhenius ini bahwa Asam
adalah senyawa yg dalam Air mampu menghasilkan Ion Hidroksida (OH-) dan Basa
berdasarkan pada Ion OH- yang dilepaskan tersebut pada reaksi Ionisasi Basa
maka dibedakan menjadi dua macam yang antara lain Basa Monohidrolik dan Basa
Polihidroksi.
2. Teori Asam Basa Bronsted – LowryTeori Asam Basa Bronsted dan
Lowry ini merupakan sebuah Teori yang melengkapi dari kekurangan Teori Asam dan
Basa Arrhenius karena tak semua Senyawa itu bersifat Asam ataupun Basa dapat
menghasilkan sebuah Ion H+ atau OH- jika dilarutkan didalam Air.Teori Asam Basa Menurut Bronsted
– Lowry bahwa Asam ialah Senyawa yg bisa menyumbang proton yakni Ion H+ ke
Senyawa atau Zat Lain. Sedangkan Basa ialah Senyawa yg bisa menerima Proton,
yakni Ion H+ dari Senyawa ataupun Zat Lain. Lalu menurut Johannes Nicolaus
Bronsted dan Thomas Martin Lowry bahwa Zat mampu berperan baik sebagai Asam
ataupun Basa, jika Zat tertentu lebih mudah melepas Proton dan Zat tersebut
akan berperan sebagai Asam dan Lawannya berperan sebagai Basa.Sebaliknya jika Suatu Zat lebih
mudah menerima Proton maka Zat tersebut akan berperan sebagai basa dan dalam
suatu Larutan Asam dalam Air, Air tersebut berperan sebagai Basa. Namun didalam
Teori Asam – Basa Bronsted Lowry ini memiliki kelemahan yakni tak dapat
memperlihatkan Sifat Asam maupun Sifat Basa suatu senyawa jika tidak terdapat
proton yang terlibat didalam Reaksi.3. Teori Asam Basa LewisGilbert Newton Lewis merupakan
Ilmuwan Kimia berasal dari Amerika Serikat yang lahir pada 23 Oktober 1875 dan
meninggal pada 23 Maret 1946 yang terkenal dengan penemuan – penemuannya
seperti Ikatan Kovalen, Struktur Lewis dan Asam Basa Lewis. Menurut Gilbert
Newton Lewis bahwa Teori Asam – Basa merupakan masalah dasar yg harus
diselesaikan dengan landasan Teori Struktur Atom, bukan berdasarkan oleh hasil
percobaan.Adapun Teori Asam Basa Menurut
Lewis bahwa Asam ialah Zat yang dapat menerima Elektron dan menurut Lewis bahwa
Basa ialah Zat yang bisa mendonorkan Pasangan Elektron. Semua Zat yg
didefinisikan sebagai Asam didalam Teori Asam – Basa Arrhenius juga merupakan
Asam di dlm Kerangka Teori Lewis ini karena Proton ialah Aksepator Pasangan
Elektron dan didalam Reaksi Netralis Proton dapat membentuk ikatan koordinat
dengan Ion Hidroksida.
2.5.3 SIFAT-SIFAT ASAM BASA
1. Sifat-sifat asam yaitu :
·
Rasanya masam/asam
·
Bersifat korosif atau merusak
·
Bila dilarutkan dalam air dapat
menghasilkan ion H+ atau ion ion hidrogen dan ion sisa asam yang bermuatan
negatif. Peristiwa terurainya asam menjadi ion-ion dapat di tuliskan sebagai
berikut: HA (aq) H+
(aq) + A- (aq)
·
Bila diuji dengan indikator kertas lakmus
biru dapat mengubah lakmus tersebut menjadi merah. Sedangkan jika diuji dengan
indikator kertas lakmus yang berwarna merah, kertas lakmus tersebut tidak akan
berubah warna. Indikator adalah suatu alat untuk menunjukkan suatu zat apakah
bersifat asam maupun basa.
2. Sifat-sifat basa yaitu:
·
Rasanya pahit
·
Bersifat kaustik atau dapat merusak kulit
·
Bila dilarutkan dalam air dapat
menghasilkan ion OH- atau ion hidroksil dan ion logam atau gugus lain yang
bermuatan negatif. Apabila ion OH- hampir seluruhnya dilepaskan atau
ionisasinya sempurna, maka termasuk basa kuat atau dikatakan memiliki derajat keasaman
yang rendah dan begitu juga sebaliknya. Secara umum peristiwa peruraian basa
menjadi ion-ion dapat dituliskan sebagai berikut: BOH (aq) B+ (aq) + OH- (aq)
·
Bila diuji dengan indikator yang berupa
lakmus merah, maka akan mengubah warna lakmus tersebut menjadi warna biru,
sedangkan dengan kertas lakmus biru, tidak akan mengubah warna kertas lakmus
tersebut.
Sebagai Contoh bila
Asam Kuat direaksikan dg Basa Kuat maka akan menghasilkan suatu Garam Netral
dengan pH sama dengan 7 dan jika Asam Kuat direaksikan dengan Basa Lemah maka
akan menghasilkan suatu Garam dengan Sifat Asam. Namun jika Asam Lemah
direaksikan dengan Basa Kuat maka akan menghasilkan Garam dengan Sifat Basa,
apabila Asam Lemah direaksikan dengan Basa Lemah maka akan menghasilkan suatu
Garam dengan Sifat tergantung kepada Nilai ka ataupun kb didalamnya.
Garam
adalah senyawa yang dihasilkan dari reaksi netralisasi antara
larutan asam dan larutan basa. Larutan garam yang terbentuk memiliki sifat yang bervariasi,
tergantung pada sifat asam dan sifat basa penyusun garam. Secara
umum :
Asam + Basa → Garam + Air
Berikut ini adalah beberapa
contoh reaksi
pembentukan garam (dikenal pula dengan istilah reaksi
penggaraman atau reaksi netralisasi)
:
HCl(aq) +
NaOH(aq) → NaCl(aq) + H2O(l)
H2SO4(aq) +
2 NH4OH(aq) → (NH4)2SO4(aq) +
2 H2O(l)
2 HCN(aq) +
Ba(OH)2(aq) → Ba(CN)2(aq) + 2 H2O(l)
H2CO3(aq) +
Mg(OH)2(aq) → MgCO3(s) + 2 H2O(l)
Reaksi kebalikan dari
reaksi penggaraman dikenal
dengan istilah reaksi hidrolisis. Reaksi hidrolisis adalah
reaksi salah satu ion atau kedua ion larutan garam dengan air. Reaksi salah
satu atau kedua ion larutan garam dengan air menyebabkan perubahan konsentrasi
ion H+ maupun ion OH– dalam larutan. Akibatnya,
larutan garam dapat bersifat asam, basa, maupun netral.
Sebagaimana yang telah kita
pelajari sebelumnya, kita mengenal dua jenis asam, yaitu asam kuat dan asam
lemah. Demikian halnya dengan basa, kita mengenal istilah basa kuat dan basa
lemah (lihat : Kimia
Asam Basa). Dengan demikian, terdapat
empat variasi reaksi antara asam dan basa membentuk garam, yaitu :
1. Reaksi antara asam kuat
dengan basa kuat
Contoh : HBr(aq) +
KOH(aq) → KBr(aq) + H2O(l)
Garam yang terbentuk mengalami ionisasi
sempurna dalam air
KBr(aq) → K+(aq) +
Br–(aq)
Baik kation maupun anion, hanya
terhidrasi oleh air, tidak mengalami reaksi dengan air. Dengan demikian, garam tersebut tidak
terhidrolisis dalam air. Akibatnya, konsentrasi ion H+ tidak
berubah terhadap konsentrasi ion OH–. Larutan garam bersifat netral.
Larutan garam tersebut memiliki pH = 7.
2. Reaksi antara asam kuat
dengan basa lemah
Contoh : HNO3(aq) +
NH4OH(aq) → NH4NO3(aq) +
H2O(l)
Garam yang terbentuk mengalami
ionisasi sempurna dalam air
NH4NO3(aq) →
NH4+(aq) + NO3–(aq)
Anion tidak mengalami hidrolisis
dengan air, sebab anion berasal dari spesi asam kuat. Namun sebaliknya, kation
yang berasal dari spesi basa lemah mengalami hidrolisis. Reaksi yang terjadi adalah sebagai berikut :
NH4+(aq) +
H2O(l) <——> NH4OH(aq) +
H+(aq)
Hidrolisis kation yang berasal
dari basa lemah menghasilkan ion H+. Akibatnya, konsentrasi ion H+ menjadi
lebih tinggi dibandingkan konsentrasi ion OH–. Dengan demikian,
larutan garam tersebut mengalami hidrolisis sebagian (parsial). Larutan garam
tersebut bersifat asam dan memiliki pH < 7.
3. Reaksi antara asam lemah
dengan basa kuat
Contoh : HCN(aq) +
NaOH(aq) → NaCN(aq) + H2O(l)
Garam yang terbentuk mengalami
ionisasi sempurna dalam air
NaCN(aq) →
Na+(aq) + CN–(aq)
Kation tidak mengalami hidrolisis
dengan air, sebab kation berasal dari spesi basa kuat. Namun sebaliknya, anion
yang berasal dari spesi asam lemah mengalami hidrolisis. Reaksi yang terjadi adalah sebagai berikut :
CN–(aq) +
H2O(l) <——> HCN(aq) +
OH–(aq)
Hidrolisis anion yang berasal
dari asam lemah menghasilkan ion OH–. Akibatnya, konsentrasi ion OH– menjadi
lebih tinggi dibandingkan konsentrasi ion H+. Dengan demikian,
larutan garam tersebut mengalami hidrolisis sebagian (parsial). Larutan garam
tersebut bersifat basa dan memiliki pH > 7.
4. Reaksi antara asam lemah
dengan basa lemah
Contoh : HF(aq) +
NH4OH(aq) → NH4F(aq) +
H2O(l)
Garam yang terbentuk mengalami
ionisasi sempurna dalam air
NH4F(aq) →
NH4+(aq) + F–(aq)
Baik kation maupun anion,
sama-sama mengalami hidrolisis, sebab keduanya berasal dari spesi lemah. Reaksi yang terjadi adalah sebagai berikut :
NH4+(aq) +
H2O(l) <——> NH4OH(aq) +
H+(aq)
F–(aq) +
H2O(l) <——> HF(aq) +
OH–(aq)
Ternyata, hidrolisis kedua ion
tersebut menghasilkan ion H+ maupun ion OH–. Dengan
demikian, larutan garam tersebut mengalami hidrolisis total (sempurna).
Sifat larutan yang dihasilkan bergantung pada perbandingan kekuatan asam lemah
(Ka) terhadap kekuatan basa lemah (Kb).
Ada tiga kemungkinan perbandingan
nilai Ka terhadap Kb :
a. Ka > Kb : sifat asam lebih mendominasi; larutan garam
bersifat asam; pH larutan garam kurang dari 7
b. Ka =
Kb : sifat asam maupun basa
sama-sama mendominasi; larutan garam bersifat netral; pH larutan
garam sama dengan 7
c. Ka < Kb : sifat basa lebih mendominasi; larutan garam
bersifat basa; pH larutan garam lebih dari 7
Persamaan yang dapat digunakan
untuk menghitung pH larutan masing-masing larutan garam adalah sebagai berikut
:
1. Larutan garam yang terbentuk
dari asam kuat dan basa kuat
pH = 7
2. Larutan garam yang terbentuk
dari asam kuat dan basa lemah
[H+] = {(Kw/Kb)([ion
yang terhidrolisis])}1/2
3. Larutan garam yang terbentuk
dari asam lemah dan basa kuat
[OH–] =
{(Kw /Ka)([ion yang terhidrolisis])}1/2
4. Larutan garam yang terbentuk
dari asam lemah dan basa lemah
[H+] = {Kw (Ka /
Kb)}1/2
Berikut ini adalah beberapa
contoh beserta penyelesaian soal-soal yang berkaitan dengan hidrolisis
garam yang baru saja kita pelajarai bersama :
1. Berapakah pH larutan dari 100
mL larutan natrium sianida 0,01 M? (Ka HCN = 10-10)
Penyelesaian :
Larutan natrium sianida terbentuk
dari campuran basa kuat (NaOH) dengan asam lemah (HCN). Dengan demikian,
larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
NaCN(aq) →
Na+(aq) + CN–(aq)
Ion yang terhidrolisis adalah ion
CN–. Konsentrasi ion CN– adalah 0,01 M. Dengan
demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
[OH–] =
{(Kw /Ka)([ion yang terhidrolisis])}1/2
[OH–] =
{(10-14 / 10-10)(0,01)}1/2
[OH–] = 10-3 M
Dengan demikian, pOH larutan
adalah 3. Jadi, pH larutan garam tersebut adalah 11.
2. Berapakah pH larutan dari 200
mL larutan barium asetat 0,1 M? (Ka CH3COOH = 2.10-5)
Penyelesaian :
Larutan barium asetat terbentuk
dari campuran basa kuat (Ba(OH)2) dengan asam lemah (CH3COOH).
Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan
bersifat basa.
Ba(CH3COO)2(aq) →
Ba+2(aq) + 2 CH3COO–(aq)
Ion yang terhidrolisis adalah ion
CH3COO–. Konsentrasi ion CH3COO– adalah
0,2 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan
berikut :
[OH–] =
{(Kw /Ka)([ion yang terhidrolisis])}1/2
[OH–] =
{(10-14 / 2.10-5)(0,2)}1/2
[OH–] = 10-5 M
Dengan demikian, pOH larutan
adalah 5. Jadi, pH larutan garam tersebut adalah 9.
3. Hitunglah pH larutan NH4Cl
0,42 M! (Kb NH4OH = 1,8.10-5)
Penyelesaian :
Larutan amonium klorida terbentuk
dari campuran basa lemah (NH4OH) dengan asam kuat (HCl). Dengan
demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat
asam.
NH4Cl(aq) →
NH4+(aq) + Cl–(aq)
Ion yang terhidrolisis adalah ion
NH4+. Konsentrasi ion NH4+ adalah
0,42 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan
berikut :
[H+] = {(Kw /Kb)([ion
yang terhidrolisis])}1/2
[H+] =
{(10-14 / 1,8.10-5)(0,42)}1/2
[H+] =
1,53.10-5 M
Dengan demikian, pH larutan garam tersebut adalah 4,82.
Ciri-ciri reaksi asam + basa:
1.
Reaksi asam-basa bisa
digunakan senyawa asam kuat dan basa kuat, maupun asam lemah dan basa lemah
2.
Reaksi asam + asam
tidak akan terjadi, begitu juga dengan reaksi basa + basa
3.
Reaksi asam + basa
terjadi dengan perpindahan ion-ion di senyawa asam dan basa
4.
Hasil reaksinya
berupa senyawa garam dan air
Ingat, bahwa reaksi asam-basa ini
juga sangat penting untuk perhitungan pH selanjutnya, yaitu pH hidrolisis garam
dan pH buffer.
Perhatikan skema berikut!
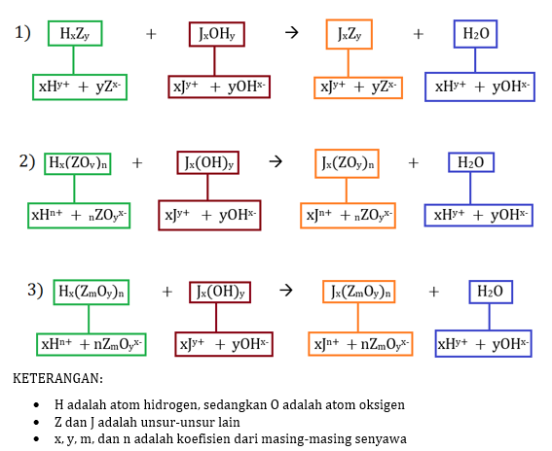
(Rumus reaksi asam basa).
2.6 TERJADINYA REAKSI
METATESIS
Reaksi
metatesis adalah reaksi pertukaran ion dari dua buah elektrolit pembentuk
garam, terdapat tiga jenis reaksi penggaraman yang mungkin yaitu; garam LA
dengan garam BX, garam BX dengan asam HA dan garam LA dengan basa BOH. Selain
itu, Reaksi metatesis juga adalah reaksi-reaksi kimia yang melibatkan
pertukaran atom/ion atau gugus atom/gugus ion dengan atom/ion atau gugus
atom/gugus ion yang lain.
Reaksi ini secara umum dapat dituliskansebagai
berikut:
AB + CD à AD + CB.
Reaksi metatesis dapat terjadi
jika salah satu hasil reaksi berupa endapan atau gas, dengan kata lain salah
satu hasil reaksi memiliki kelarutan yang rendah didalam air.
1. Garam LA + garam BX → garam LX
+ garam BA.
Contoh :
NaCl + AgNO3 → AgCl(s) + NaNO3
Reaksi ini menghasilkan endapan
berwarna putih untuk senyawa AgCl, dalam reaksi dituliskan tanda (s) berarti
solid.
2. Garam BX + asam HA → Garam BA
+ Asam HX
Contoh :
FeS + 2 HCl → FeCl2 + H2S(g)
Hasil reaksi berupa gas H2S yang
dapat lepas keluar dari tempat berlangsungnya reaksi.
3. Garam LA + basa BOH → Garam BA
+ LOH.
Contoh :
NH4Cl + KOH → KCl + NH4OH
Reaksi ini berlanjut dengan menguraikan
senyawa NH4OH
NH4OH ⇄ H2O + NH3(g).
Dalam reaksi metatesis, ada dua
reaksi pertukaran diantaranya adalah sebagai berikut :
1)
Reaksi pertukaran tunggal
Reaksi pertukaran tunggal adalah
reaksi-reaksi yang melibatkan pertukaran sebuah unsure dengan unsure lain dalam
suatu senyawa
Contoh:
2AgCl (aq) +
Cu (s) → 2Ag (s) + CuCl2 (aq)
2)
Reaksi pertukaran ganda
Reaksi pertukaran ganda adalah
reaksi reaksi yang melibatkan pertukaran antara dua pereaksi.
Contoh :
AgNO3(aq) +
NaCl (aq) → AgCl (s) + NaNO3 (aq)
Selain itu reaksi pertukaran
ganda adalah reaksi kimia yang melibatkan pertukaran antar ion-ion dalam
senyawa yang bereaksi.
Contoh:
Larutan natrium sulfat bereaksi dengan barium nitrat membentuk endapan putih dari barium sulfat.
Larutan natrium sulfat bereaksi dengan barium nitrat membentuk endapan putih dari barium sulfat.
Persamaan reaksinya:
Na2SO4(aq) + Ba(NO3)2(aq) ⎯⎯→ 2NaNO3(aq) + BaSO4(s)
Jika ditinjau berdasarkan produk
yang dihasilkan,maka reaksi metatesis masih dapat dibedakan menjadi beberapa
jenis reaksi,antara lain sbb:
1)
Reaksi pembentukan endapan
Endapan merupakan zat padat yang
memiliki kelarutan yang sangat kecil dalam air dan dihasilkan dari suatu reaksi
kimia.
Endapan dapat terbentuk apabila
kation dari pereaksi satu bereaksi dengan anion dari pereaksi lain membentuk
senyawa yang tidak mudah larut dalam larutannya.
Contoh:
AgNO3(aq) +
NaCl (aq) → AgCl (s) + NaNO3 (aq)
2)
Reaksi pembentukan gas
Gas dapat terbentuk apabila
produk yang dihasilkan dari suatu reaksi tidak larut dalam air dan titik
didihnya rendah.Gas juga dapat terbentuk apabila produk dari suatu reaksi tidak
stabil hingga terurai menjadi gas dan zat lain.
Contoh:
Zn (s) +
2HCl (aq) → ZnCl2 (aq) + H2
(g)
3)
Reaksi penetralan
Reaksi penetralan merupakan reaksi antara larutan asam dan basa.Penetralan terjadi antara ion H+ dari asam dan ion OH- dari basa,membentuk molekul netral H2O.Penetralan dapat terjadi apabila jumlah mol kedua ion di atas sama banyak.
Contoh :
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (aq)
DAFTAR PUSTAKA
Andy.
2009. Pre-College Chemistry.
Chang,
Raymond. 2007. Chemistry Ninth Edition.
New York: Mc Graw Hill.
Tidak ada komentar:
Posting Komentar